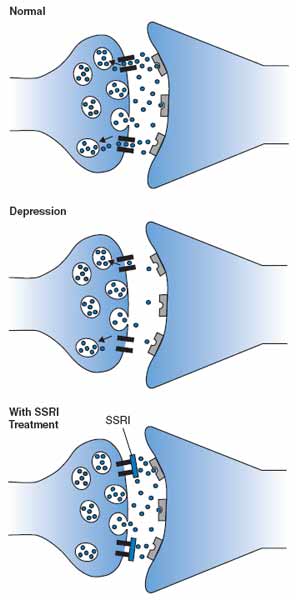
Non c'è bisogno di alcun farmaco per indurre questo calo, basta una dieta povera dell'aminoacido triptofano, il precursore della serotonina.
"Too much information is even worse than no information at all," mi disse un saggio. Io voglio correggere questo detto cercando di recuperare dalla "nuvola" scientifica (life sciences & astronomia in primis) alcune fra le notizie più interessanti ma sconosciute ai più, a causa dell'appiattimento dei media generalisti sulle stesse identiche notizie di agenzia.
CC
Questo opera di above the cloud è concesso sotto la Licenza Creative Commons Attribuzione 3.0 Italia.
Based on a work at scienceabovetheclouds.blogspot.com.
The Copyright Laws of the United States recognizes a “fair use” of copyrighted content. Section 107 of the U.S. Copyright Act states: “Notwithstanding the provisions of sections 106 and 106A, the fair use of a copyrighted work (...) for purposes such as criticism, comment, news reporting, teaching, scholarship, or research, is not an infringement of copyright.”
Any image or video posted is used according to the fair use policy
QUALUNQUE link in questa pagina rimanda a siti sicuri!! SEMPRE.
Volete aiutare questo blog? Cliccate sugli annnunci/prodotti Amazon (se non li vedete, disattivate l'Adblocker mettendo questo sito nella whitelist. NON ci sono pop up o script strani, SOLO Amazon). Visibili in modalità desktop! Se poi decidete di comprare libri o servizi da Amazon, meglio ;-)
Dimenticavo. Questo blog NON contiene olio di palma (è così di moda specificarlo per ogni cosa...)
I dubbi sull'ipotesi serotonina-depressione
Il boom in borsa dei farmaci antidiabetici che fanno anche perdere peso
Alla fine dello studio durato poco meno di 3 anni e mezzo è stato inserito un periodo di 17 settimane senza farmaco così da avere un quadro completo della funzione farmacologica e della durata dell'effetto nei mesi successivi. Vero che al termine del trattamento i pazienti hanno iniziato a riprendere peso mostrando una alterazione dei parametri in senso diabetico ma il fattore di rischio di sviluppare il diabete propriamente detto è risultato inferiore dell’88% rispetto a prima di iniziare il trattamento. Un trattamento che come per tante terapie della sindrome metabolica deve essere continuativo, sebbene (i dati lo confermano) possa essere interrotto senza grossi problemi.
Tali osservazioni avevano convinto molti medici a prescriverla off-label a individui obesi. Ricordo che in assenza di studi clinici dedicati un farmaco (approvato per altro scopo) NON può essere prescritto come terapia per altra patologia. La FDA ha autorizzato l’uso come farmaco per la perdita del peso solo nel 2023, nella formulazione nota come Zepbound.
Nei soggetti sani il livello dell’ormone si abbassa durante il digiuno, il che è innesca lo stimolo della fame. Negli individui obesi il livello si mantiene basso e questo spiega la loro ricerca di cibo anche subito dopo avere mangiato. Ulteriori dettagli a fine articolo **.Nota aggiuntiva. Uno studio recente ha dimostrato come l'atto di ingoiare induca il rilascio di serotonina (ormone associato alla sensazione di piacere) che spiega come, in individui predisposti, il mangiare invece di indurre sazietà porti ad un rinforzo del piacere di mangiare.
Funghi allucinogeni per trattare la dipendenza da alcol?
Vi rimando sull'argomento ai precedenti articoli sulla ketamina (approvata per la depressione resistente ai farmaci) e sugli allucinogeni in generale.
 |
| image from myscience.org |
Gli effetti allucinogeni della psilocibina sono legati alla sua azione sui recettori della serotonina 5-HT2A che vengono iperprodotti dopo l'assunzione.
Prova finale per dimostrare il coinvolgimento di questi recettori 5-HT2A, misurare gli effetti della psilocibina sul consumo di alcol dopo averli "inattivati" usando un bloccante specifico come la ketanserina. A conferma della predizione l'infusione del bloccante nel NAc sinistro eliminava l'effetto di riduzione dell'alcol mentre nessun cambiamento avveniva dopo infusione nel NAc destro.
I farmaci "psichedelici". Una risorsa di cui però si ignora il meccanismo di azione
 |
| Illustration by Kasia Bojanowska |
 |
| Libro in cui si tratta, con piglio giornalistico/antropologico delle 4 principali piante con attività psicotropa (credit: Amazon) |
Vero che anche gli antidepressivi classici, come il Prozac (fluoxetina), si legano al recettore, ma il legame è fino a 1000 volte più debole rispetto agli psichedelici, il che spiega perché uno sembri migliorare i sintomi in poche ore, mentre gli altri richiedano molti mesi.
Ad esempio alcune condizioni patologiche come autismo e schizofrenia, potrebbero (talvolta) derivare da un’eccessiva plasticità del cervello. Inoltre, tutti i tipi di droga, comprese la cocaina e le anfetamine, possono indurre una sorta di plasticità e tutto noi conosciamo l'effetto negativo (fisico e psichico) indotto da queste sostanza.
In un esperimento di somministrazione ai topi di queste sostanze (MDMA, ibogaina, LSD, ketamina o psilocibina) si sono osservati risultati comportamentali interessanti. I topi trattati sono diventati più disposti a dormire in uno scompartimento con altri (chiaro segno di riduzione di stress) e l’effetto è durato per settimane. Poiché i topi adulti non tendono a cambiare il loro comportamento sociale, la scoperta suggerisce che i farmaci psichedelici sono stati in grado di riaprire il “periodo critico”, la fase in cui i topi giovani imparano ad associare la socialità a qualcosa di positivo. Nello stesso studio si è anche scoperto che i neuroni degli animali trattati hanno iniziato a esprimere un insieme di geni coinvolti nel rimodellamento della matrice extracellulare, una zona che che funge da “malta” tra i neuroni: il rimodernamento libera i dendriti e gli assoni dando loro la capacità di formare nuove connessioni.
Vero anche che l'esketamina, la versione modificata della ketamina approvata per la terapia antidepressiva (necessita di dosaggio molto inferiori e questo evita gli effetti collaterali della droga), non è inferiore alla ketamina per cui è possibile agire sulla riduzione degli effetti allucinogeni.
Una misurazione del problema placebo viene dai ricercatori di Heifets Labs che hanno sviluppato un modo per quantificare l’intensità dell’effetto placebo; il team di ricerca ha testato la ketamina su persone sottoposte a intervento chirurgico che erano state messe sotto anestesia e incapaci di sperimentare gli effetti dissociativi del farmaco. Le persone che escono dall’intervento chirurgico spesso sperimentano sintomi di depressione accentuati. Ma i ricercatori hanno scoperto che, indipendentemente dal fatto che un paziente avesse ricevuto ketamina o un placebo, i suoi sintomi miglioravano se pensavano che avrebbero potuto assumere il farmaco: l’aspettativa stessa di ricevere il farmaco stesso avrebbe potuto migliorare il loro umore.
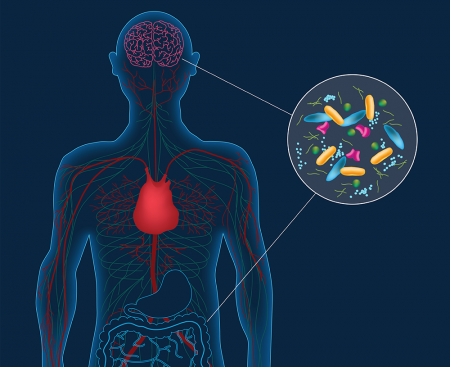
Una linea diretta tra cervello e stato microbiota intestinale
Il sistema nervoso enterico si basa sullo stesso tipo di neuroni e neurotrasmettitori che si trova nel sistema nervoso centrale
Sul tema vedi i precedenti articoli (tag "microbioma"), ad esempio "microbioma: un ecosistema"
Nello specifico NOD2 riconosce un tipo particolare di peptidoglicani noti come muropeptidi il cui nome indica i peptidoglicani associati alla parete cellulare batterica.Varianti del gene NOD2 sono state associate ad un aumento (40x) del rischio di sviluppare il morbo di Crohn, nonché a malattie neurologiche e disturbi dell'umore.
La presenza di muropeptidi nell'intestino, sangue e cervello è un biomarcatore dello stato di proliferazione batterica, più elevata e maggiore la crescita. Da qui il senso del sistema di feedback negativo per cui quando le cellule dell'ipotalamo rilevano una aumentata proliferazione, viene diminuita la voglia di assumere altro cibo e minore regolazione della temperatura. I topi femmina sono anche meno propensi a costruire un nido, indice che le condizioni non sono ideali.
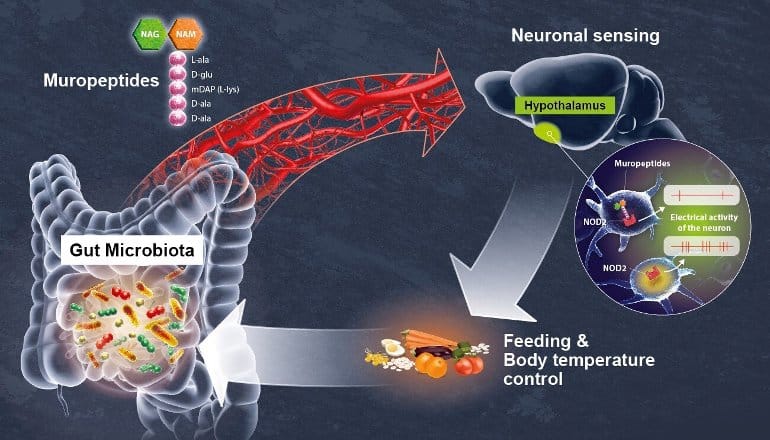 |
| Credit: Institut Pasteur / Pascal Marseaud via neurosciencenews.com |
Antidepressivi e il loro (nuovo) utilizzo come anti-tumorali
Del riposizionamento farmacologico degli antidepressivi ne scrivevo già nel 2013 e la loro azione antitumorale era già stata osservata nel 2020 (vedi nota a fondo pagina). Alla "nuova vita" di questi farmaci ha fatto da contraltare negli ultimi anni anche il processo opposto con la scoperta nella di un potente effetto antidepressivo nella ketamina (un anestetico divenuto famoso come droga dei rave party) che si è rivelato utile per il trattamento delle forme di depressione resistenti ai farmaci.
 |
| image credit: scitechdaily |
 |
| Image credit: neurosciencenews.com |
Il meccanismo in sé è assolutamente naturale e serve come segnale per indicare alle cellule di sorveglianza “guarda che siamo cellule normali del tuo stesso organismo, quindi spegniti e non attaccarci”, prevenendo così il rischio di reazioni autoimmunitarie.
Nel dettaglio PD-L1 si lega alla proteina PD-1 espressa sulla superficie dei linfociti T citotossici e delle natural killer, bloccandone l’azione.
A sinistra la cellula tumorale "spegne" l'attacco della cellula T nonostante l'avvenuto riconoscimento del bersaglio tumorale a causa del segnale mediato da PD-L1. A destra l'effetto di una terapia basata su anticorpi anti PD-L1 che impediscono il contatto, permettendo così l'attacco distruttivo contro il tumore.
(Image credit: Joaquin Bellmunt et al (2017))
NOTA. Nel 2020 uno studio olandese, pubblicato su Molecular Cancer Therapeutics, aveva osservato una inattesa funzione antitumorale nell'antidepressivo sertralina.Tra i trucchi usati dalle cellule tumorali per sostentare la propria crescita vi è la produzione di grandi quantità di serina e glicina. Questa produzione stimola la proliferazione delle cellule tumorali a tal punto da renderle dipendenti dalla presenza, non limitante, di questi due aminoacidi. Sebbene anche le cellule sane si avvalgano di tale meccanismo, ne sono molto meno dipendenti e possono "contentarsi" della quantità di glicina e serina assorbita dall'intestino; questo non è invece sufficiente per le cellule tumorali.Durante la ricerca di molecole in grado di contrastare questa dipendenza, i ricercatori scoprirono che l'antidepressivo sertralina, specie in associazione ad altri trattamenti, bloccava la crescita tumorale inibendo la sintesi della serina, affamando così in modo selettivo le cellule tumorali.
Morbo di Parkinson e batteri intestinali. Una "liaison" pericolosa da approfondire
 |
| Le aree più ricche di neuroni dopaminergici sono le più danneggiate nel Parkinson |
Il 75% delle persone con PD presenta inoltre problemi nella funzionalità gastrointestinale che si palesano principalmente con sintomi di costipazione.
 |
| Il microbiota opera per il nostro benessere (se bilanciato) |
Il primo viene costantemente "tenuto in esercizio" e "modulato" in modo da abituarsi ai batteri "buoni" (essenziali sia da un punto di vista metabolico che come competitori dei ceppi patogeni) e in grado di autoregolarsi evitando così il permanere di stati infiammatori.
Il secondo aspetto è diretta conseguenza del fatto che il 70% di tutti i neuroni del sistema nervoso periferico si trova nell'intestino e che ad esempio la serotonina (uno dei neurotrasmettitori chiave per l'umore) è prodotta per il 90% in questo distretto. Il sistema nervoso dell'intestino è direttamente collegato al sistema nervoso centrale attraverso il nervo vago, il che aiuta a comprendere meglio come la qualità del cibo possa influenzare l'umore e viceversa come l'umore abbia effetti sulla digestione. Non a caso Michael Gershon ha titolato brillantemente il suo libro "Il secondo cervello" per sottolineare la centralità dell'intestino anche nelle funzioni "alte".
 |
| Credit: Caltech |
L'eziologia della malattia è complessa anche nelle forme familiari dove la forma monogenica (un solo gene alterato responsabile) non supera il 30% dei casi ereditari (che ricordo sono il 10% del totale dei casi). Il che pone un problema diagnostico non indifferente nei soggetti sani ma a rischio (per familiarità) dato che il restante 70% delle forme ereditarie sarà per definizione poligenico, vale a dire conseguente alla mutazione o deregolazione di due o più geni (18 sono i geni "parkinsoniani" più comuni). Il problema è ancora più evidente quando non si dispone di biopsie dei genitori deceduti da cui ricavare il profilo genetico a rischio. Oltre alla αSyn i geni più frequentemente alterati nei malati sono PARK2, UCH-L1, LRRK2, PINK1 e DJ-1 (per approfondimenti --> "Genetics of Parkinson’s Disease").
Nessuna differenza è stata invece riscontrata usando topi normali come popolazione di partenza, e questo è il controllo essenziale per definire l'importanza della alterazione in αSyn.
In altre parole le cause sono una summa di genetica e "ambiente".
Nota. Già in un precedente articolo avevo accennato a questo approccio "strano" ma molto promettente per la terapia di patologie intestinali croniche come la sindrome del colon irritabile. Si è visto che per compensare squilibri (innati o acquisiti) nella flora intestinale che causano la comparsa di uno stato infiammatorio cronico, è possibile trapiantare la popolazione batterica presente nell'intestino dei soggetti sani in quello dei malati (attraverso un "banale" trasferimento di materia fecale dall'intestino del primo verso i secondi); tale trattamento è sufficiente per eliminare i sintomi più acuti della malattia, altrimenti difficilmente trattabili.
Nota. Ho scritto rallentare e non invertire in quanto i sintomi motori compaiono quando circa l'80% dei neuroni dopaminergici in alcune aree sono morti, quindi quando i danni sono molto estesi
Articoli precedenti sul tema --> "Parkinson"
Caltech/news
Il cuore spezzato è come la dipendenza da cocaina
| Il nucleus accumbens attivato nella fase di reward (S. Mackey and J. Younger) |
Esempio classico di autodoping fisiologico è quello che si sperimenta con la sensazione di benessere alla fine della sessione quotidiana di jogging. Una sensazione che ci "vizia", se svolta con frequenza regolare, a tal punto da indurre stati simili all'astinenza quando si saltano sessioni di allenamento: il nervosismo di chi non è riuscito a fare la corsa quotidiana non è altro che la manifestazione del calo dei livelli degli endocannabinoidi (e in misura inferiore delle endorfine), entrambe molecole che il corpo rilascia per attenuare lo stress legato all'attività fisica (J. Fuss et al, PNAS, 2015).
- ossitocina, essenziale per il "bonding" (la creazione di un legame emotivo tipo quello madre-neonato);
- dopamina, prodotta nella parte basale/posteriore dell’encefalo e trasportata all’occorrenza verso i lobi frontali della corteccia. Trasporto che avviene dopo una grossa soddisfazione (premio) o quando il cervello vuole limitare l'entità di uno stato negativo.
E se la secrezione di dopamina prodotta dai circuiti classici non è sufficiente per "riattivare" il comportamento normale, esistono meccanismi per stimolarne la produzione. Se i meccanismi di compensazione sono inefficienti si casca nella situazione descritta in apertura di articolo.
Molte specie di mammiferi superiori evitano in toto questo problema limitando gli incontri al solo momento dell'accoppiamento.Ma gli ormoni non fanno miracoli e infatti la gran parte dei rapporti con il partner, anche le storie vissute come totalizzanti per anni possono avere termine; una evidenza che da un punto di vista neurobiologico è sostanziata dal titolo di un articolo che riassume il lavoro condotto da un team di psicologi della università di Saint Louis. Il titolo "wired to break" (programmati per rompere) sostanzia in tre parole le cause del "collasso" dello stato di innamoramento, diverse nei due sessi:
Nelle specie in cui la presenza di entrambi i genitori è fondamentale per la sopravvivenza della progenie la natura ha dovuto implementare meccanismi in grado "incentivare" la convivenza dei partner.
- l’uomo non ama essere tradito;
- la donna detesta essere imbrogliata.
Che poi nella realtà queste aspettative vengano sempre soddisfatte, è un altro discorso.
 |
| Helen Fisher |
Il grado di tolleranza varia nelle diverse coppie le cui cause sono identificabili nell'attività cerebrale. Helen Fisher (già autrice di un buon libro divulgativo dal titolo "Perché amiamo") ha analizzato mediante risonanza magnetica l'attività cerebrale delle coppie che affermavano di essere profondamente innamorate, proprio per valutare le basi della "resistenza" ai fattori di rottura, presenti in ogni coppia. I dati ottenuti mostrano che queste coppie hanno una aumentata attività delle aree del cervello associate al piacere, le stesse che vengono attivate dall'uso di cocaina.
- 'Just Slip Out the Back, Jack' We're Wired to Get Over Romantic Break Ups
University of Saint Louis, news
- When love dies: Further elucidating the existence of a mate ejection module.
BB Boutwell et al. (2015) Review of General Psychology, 19(1)pp10-38
Lo sballo chimico dei Rave party e la terapia anti-depressiva
| Ketamina |
 |
| V. Van Gogh |
Una delle caratteristiche più pericolose associate ai trattamenti antidepressivi classici è, in assenza di attento monitoraggio, l'incremento del tasso di suicidio tra i pazienti. La cosa non deve stupire dato che un soggetto afflitto da un profondo stato depressivo è generalmente in uno stato tale da non avere la forza mentale per porre in atto le pur desiderate azioni di "soppressione dello stato di infelicità". La fase più critica è da sempre quella tra il momento in cui il soggetto comincia a manifestare un miglioramento (uscita dallo stato passivo) e quella in cui sono minimizzati gli effetti autodistruttivi.
Etichette
Clive S. Lewis
"Il concetto di probabilità è il più importante della scienza moderna, soprattutto perché nessuno ha la più pallida idea del suo significato"
Bertrand Russel
"La nostra conoscenza può essere solo finita, mentre la nostra ignoranza deve essere necessariamente infinita"
Karl Popper








