(Ultimo aggiornamento febbraio 2022)
Gli aggiornamenti al presente articolo sono indicati come tali o messi in calce al paragrafo riguardante una data variante.
Poiché queste ultime sono ordinate in ordine di "apparizione", le sezioni a fondo pagina riguardano le varianti più recenti, quindi più interessanti (per altri articoli sul tema
--> covid19).
***
La catalogazione delle varianti è stata in seguito modificata usando lettere greche invece del paese in cui sono state identificate, pare per le proteste di alcuni paesi (si spera che nel continuo subbuglio provocato dal politicamente corretto non intervengano ora i greci per contestare l'associazione del loro alfabeto al virus ...)
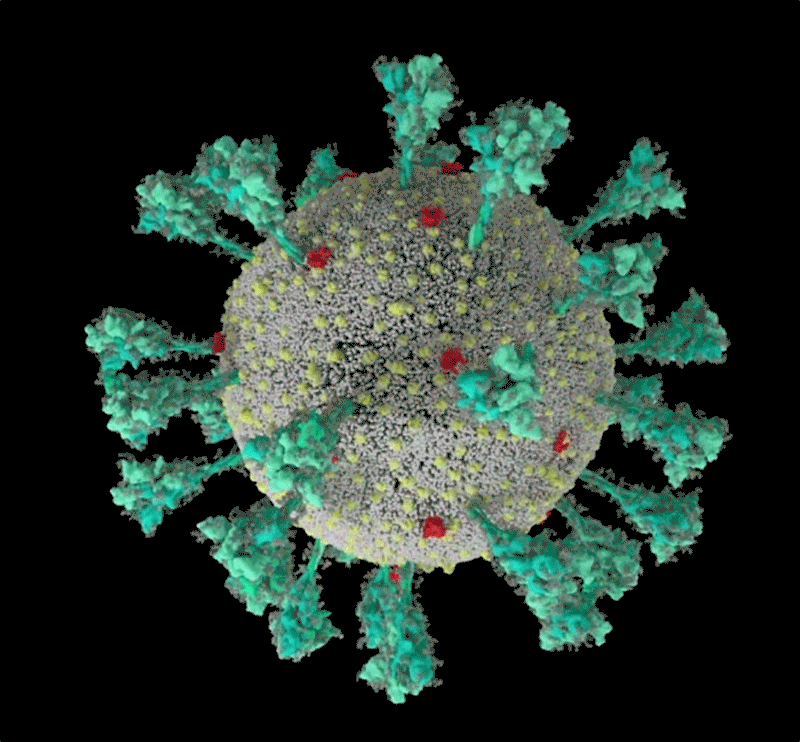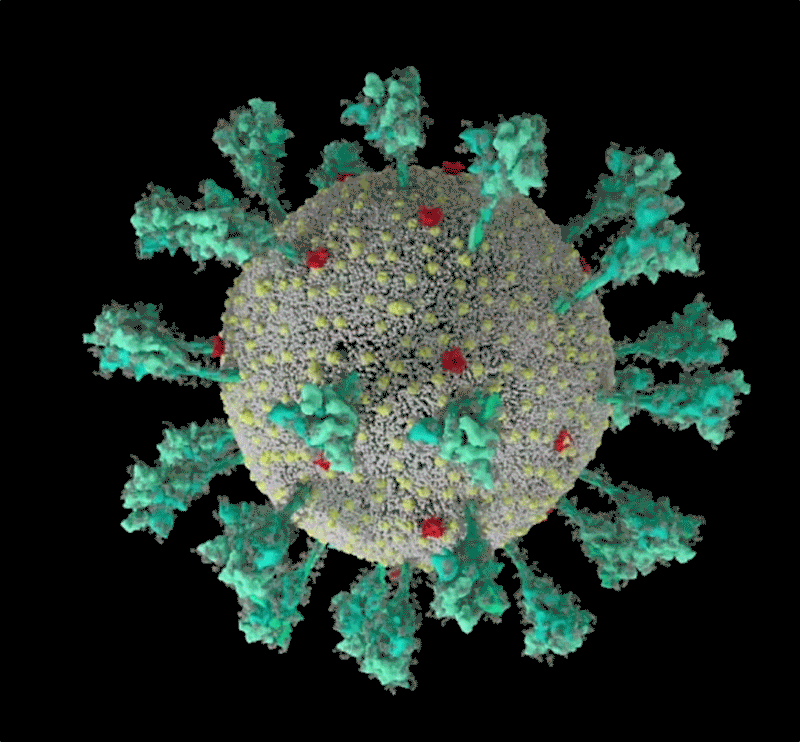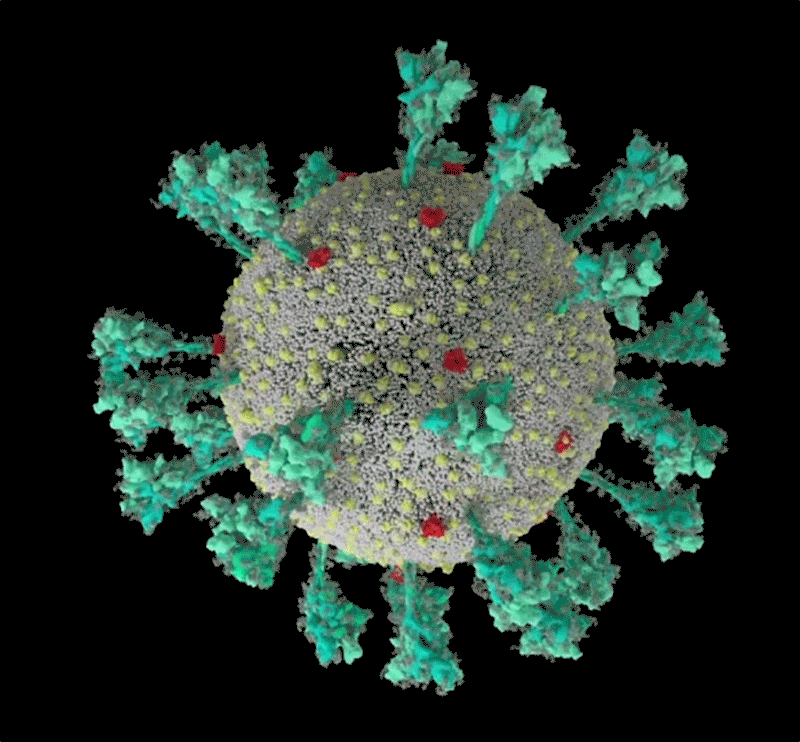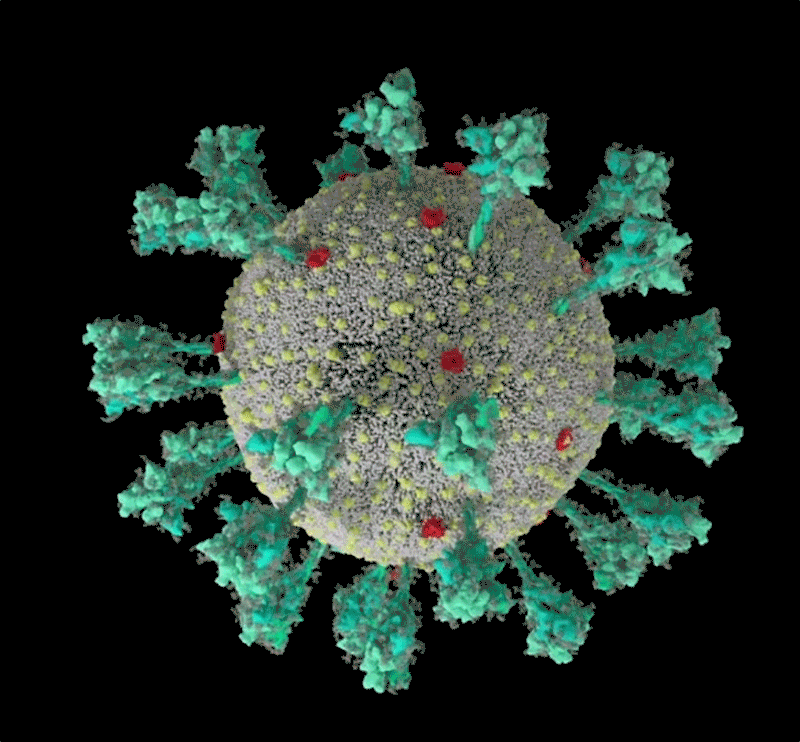
Ulteriori dettagli alla pagina
nanographics.at/... . Scaricabile in HD dalla pagina
cryo-et-renders.zip e visibile anche su
Youtube/... ..
***
Inizio con una panoramica dell'evoluzione e diffusione delle varianti virali aggiornata a gennaio 2022
I
coronavirus mutano sia a causa sia di errori intrinseci della polimerasi virale che della risposta cellulare di difesa, il cui fine è eliminare "strane" sequenze/strutture di acido nucleico (per dettagli vedi
RNA-Pol error prone e
RNA sensors).
Confusi sui molti nomi con cui sono etichettate le varianti virali? Vi rimando all'articolo dedicato.
Tra i
virus a RNA i coronavirus hanno una caratteristica insolita consistente nel minor tasso di errori in fase di replicazione. La ragione è che il complesso multiproteico deputato alla copia del RNA contiene una
subunità deputata al proofreading (la correzione degli errori di copiatura) sulla falsa riga di quella posseduta da, alcune, DNA polimerasi cellulari. Il tasso di errori di copiatura (la fonte delle mutazioni) è di conseguenza inferiore rispetto a quello di
retrovirus (virus a RNA che passa da una fase a DNA integrata nel genoma cellulare) come l'HIV o di virus a RNA come quello dell’influenza il cui tasso di variazione viene massimizzato anche grazie al
riassortimento dei filamenti di RNA (pensate a mini cromosomi, 8 nel caso del virus Influenza A) che danno luogo alle pandemie influenzali.
EDIT: un recente studio ha mostrato che la realtà è più complicata del previsto data la scoperta (per solo in laboratorio) della capacità di 3 tipi diversi di coronavirus (tra cui il Sars-CoV-2 di ricombinare (
Jennifer Gribble et al, PLOS-Pathogens, 2021)
 |
| Un graffito stradale in India per esorcizzare le paure ma ricordare che il virus è sempre in agguato (image credit to: Sanjeev Gupta/EPA via The Guardian) |
I ricercatori nei vari paesi si sono da subito messi all'opera per caratterizzare (e monitorare) l'evoluzione virale mano a mano che si passava da una epidemia locale (primi passaggi successivi alla zoonosi) alla pandemia dove il meccanismo di trasmissione era quasi esclusivamente per via umana (ulteriori passaggi animale ad umano si sono verificati in Danimarca e Olanda dai visoni di allevamento). Un processo adattativo che si porta dietro modifiche al genoma virale utili per migliorare infezione e replicazione nel nuovo contesto (ospite umano) rispetto al "prototipo" che fece il salto interspecie nei wet markets cinesi.
Tracciamento che implica sequenziamento del genoma virale e successiva comparazione tra i virus isolati in tempi e luoghi diversi.
Per dare un'idea del lavoro sottostante, a metà dicembre il numero di sequenze depositate nei database genomici era superiore a 250 mila, gran parte delle quali riferite a sequenze tra loro diverse (differenza intese come presenza di 1 o più mutazioni puntiformi e delezioni). Non è superfluo specificare che un discreto numero di queste alterazioni non sono mutazioni “propriamente dette” in quanto non influiscono sulla sequenza proteica finale e/o sulla espressione genica; si tratta ad esempio di sostituzioni nucleotidiche conservative (diverso codone, stesso aminoacido). Ottimi marcatori per i genetisti che li usano per tracciare lo spostamento (e variazione percentuale) dei virus nel tempo ma funzionalmente senza conseguenze.
Questo allo stato delle conoscenze attuali; non si può escludere che alcune di queste alterazioni apparentemente silenti impattino il livello di RNA prodotto, magari variandone la stabilità.
Il resto delle mutazioni si dividono in sostituzioni aminoacidiche conservative o modificanti, il cui effetto sulla funzionalità virale può essere accertato con test in laboratorio. In genere si tratta di mutanti con uguale o migliore funzionalità; le mutazioni deleterie per la sopravvivenza virale vengono eliminate rapidamente per selezione naturale.
La genetica ci direbbe che la mutazione migliore prende il sopravvento ma questa è una semplificazione usata solo per veicolare il messaggio. Alcune di queste varianti possono divenire le più comuni in una particolare area geografica per puro caso e non perché forniscano un vantaggio.
Possiamo semplificare il concetto pensando alla possibilità che in una data valle ci sia una maggiore frequenza di persone con i capelli rossi che nella valle adiacente. Si tratta di una conseguenza del Founder Effect (effetto del fondatore) e può verificarsi quando il numero di “coloni” fondatori di quella comunità è basso, per cui se uno di questi aveva i capelli rossi questo gene si fisserà nella popolazione locale ad una frequenza maggiore che nella valle adiacente in cui il numero di “rossi” era basso come nella popolazione di provenienza (ad es. della pianura).
Una volta che il virus entra in contatto con una popolazione si possono avere due dinamiche molto diverse. La versione classica è quella di una popolazione "vergine", priva di anticorpi per quel particolare virus e ignara del nuovo arrivato (che non attua contromisure comportamentali). Qui il virus non incontra alcuna barriera nella propagazione se non quella derivante dalla propria biologia (un virus che si trasmette per via aerea come il raffreddore sarà facilitato rispetto al virus Ebola che necessita di fluidi corporei e di lesioni). La pressione selettiva a cui è sottoposto il virus è minima una volta adattato all'umano.
Il discorso cambia quando a causa di variazioni comportamentali (non visito chi è infetto) e della crescente immunità nella popolazione (anticorpi post-esposizione e programmi di vaccinazione) diventa sempre più difficile per il patogeno sopravvivere. In questi casi il virus è sottoposto a forte pressione selettiva e con essa si ha la comparsa di mutazioni adattative necessarie per facilitarne la diffusione (es. maggiore titolo virale nel droplet o aumentata resistenza al clima esterno) e sfuggire al rilevamento da parte del sistema immunitario (diventa "invisibile" o spegne il sistema immunitario).
Prima di arrivare alla variante inglese è necessario fornire qualche altro dettaglio su come il SARS_CoV_2 aggancia la cellula bersaglio.
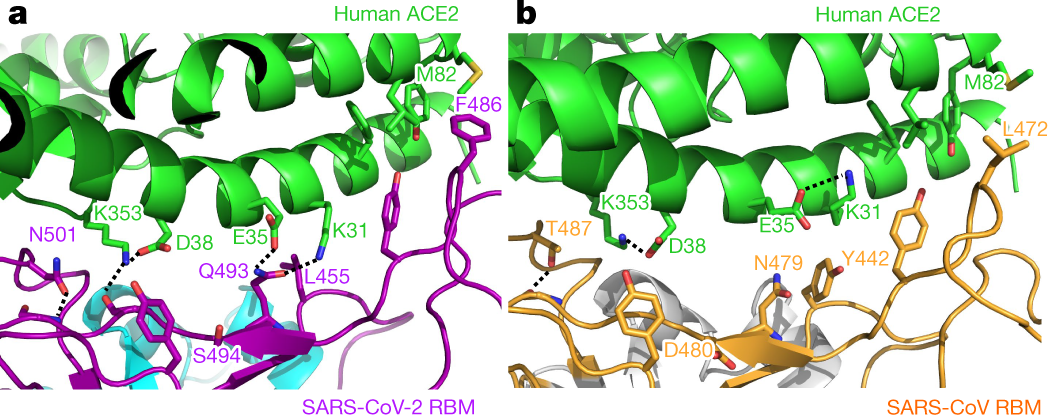
La proteina chiave per riconoscere ed entrare nella cellula si chiama Spike, ricopre l'esterno della particella virale e ha come bersaglio la proteina ACE2 esposta sulla superficie delle cellule.
 |
| Immagine artistica del virus. In rosso la proteina Spike (S). Credit: CDC |
 |
Interazione tra Spike (S), la chiave, e ACE2, la serratura, per l'ingresso nella cellula. Elemento fondamentale è RBD, in verde tratteggiato (Image credit: E. Taka et al, bioRxiv - 2020)
|
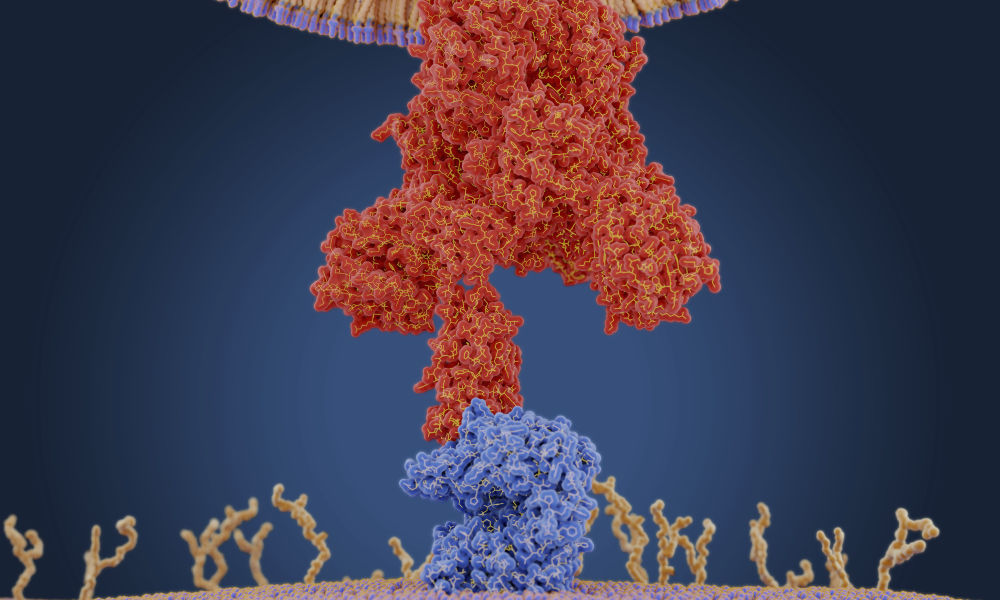 |
Dettaglio dell'interazione tra Spike (in alto, rosso) e ACE2 (blu in basso)
(Credit: Juan Gaertner / Science Source via Rochester.edu) |
Non stupisce allora che la proteina Spike sia tra le "quelle da mutare" nel processo evolutivo virale pur se con alcune limitazioni (dovrà sempre essere capace di "vedere" il bersaglio).
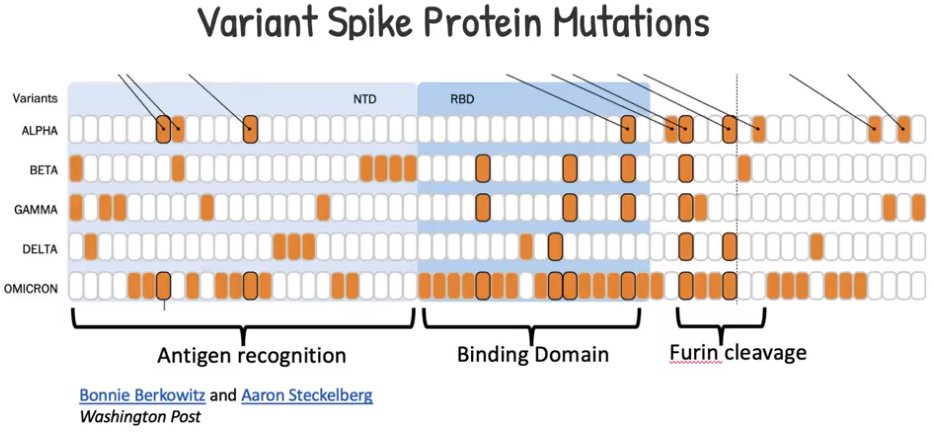
Dato confermato sperimentalmente: su oltre 150 mila genomi virali sequenziati dall'inizio della pandemia, oltre 1100 sono portatori di alterazioni (nello specifico delezioni) della proteina Spike. Mutazioni non distribuite però in modo casuale: il 90% delle delezioni si raggruppa in quattro aree del gene spike.
 |
Una panoramica delle principali mutazioni trovate a carico della proteina Spike
(credit: sfchronicle) |
Non tutta la proteina è substrato ideale perché una mutazione faccia la differenza; il sito ideale è nel
Receptor Binding Domain (RBD). Mutazioni in questa regione non solo possono migliorare il legame con il recettore ma possono anche diminuire la capacità degli anticorpi neutralizzanti di bloccare il virus.
 |
Gene e struttura 3D di Spike nella forma trimerica. In verde il dominio RBD nella conformazione "up" (image credit: D. Wrapp et al, Science)
|
Una delle mutazioni più note di Spike è la D614G (localizzata nella S1 della figura sopra) che si trova fuori dalla RBD. Emersa nelle prime fasi dell'epidemia si è poi diffusa in tutto il mondo, grazie sia alla sua contagiosità e, a cascata,
capacità di aumentare il titolo virale nelle mucose nasali e trachea (ma non nei polmoni), da cui maggiore facilità di diffusione all'esterno, che alla maggiore stabilità a temperature febbrili.
La sua diffusione ha fatto sorgere qualche preoccupazione teorica sulla capacità dei nuovi vaccini specificamente diretti contro Spike di riconoscere la variante. In verità i vaccini da poco approvati sono in giro da troppo poco tempo perché abbiano esercitato una pressione selettiva sui virus selezionando quelli capaci di eludere il vaccino. Inoltre essendo la mutazione D614G ampiamente diffusa, e da molto tempo, la protezione conferita dal vaccino non sarebbe stata così alta come invece osservato, visto che è estremamente probabile che i soggetti abbiano “incontrato” proprio questa variante dopo essere stati vaccinati. Per finire non ci sono dati che i (pochi) soggetti vaccinati che si sono ammalati (pur in forma solo lieve) si siano infettati in modo statisticamente significativo solo dopo avere incontrato la D614G.
Solo quando la copertura del vaccino diventerà significativa non dovremo sorprenderci di vedere emergere mutanti virali in grado di sfuggire alla barriera vaccinale. Per essere pronti a contrastare tali mutanti, sia
Moderna che Pfizer hanno comunicato di stare lavorando ad un "upgrade" del vaccino configurabile per chi è già vaccinato in una sorta di "richiamo".
Ho scritto "emergere" perché questi mutanti compaiono spesso nella popolazione virale ma scompaiono altrettanto rapidamente. Vale il principio no pressure-no selection.
Nota. I virus non usano solo le mutazioni per indurre variabilità ma, almeno alcuni di essi, agiscono sullo strumento di decodifica dell'informazione genetica (il ribosoma) in modo che invece di leggere una tripletta dietro l'altra "scivoli" di 1 o 2 nucleotidi generando così una proteina alterata risultato di un frameshift. La scoperta, fatta da team di università svizzere e irlandesi, potrebbe aprire un nuovo filone nel campo della drug discovery finalizzata ad interferire in questo processo.
24/05/21
Infografica aggiornata dell'efficacia dei vari vaccini rispetto alle varianti
Nota. Per quale motivo nei bambini il rischio ospedalizzazione da covid19 è quasi trascurabile? Uno studio sembra indicare che non a parità rischio di infezione i fattori protettivi includono: anticorpi contro altri coronavirus (del raffreddore, ...); prominenza della risposta immunitaria innata rispetto a quella adattativa (ancora in fase di formazione) -->Nature settembre 2021
Un riassunto schematico per iniziare
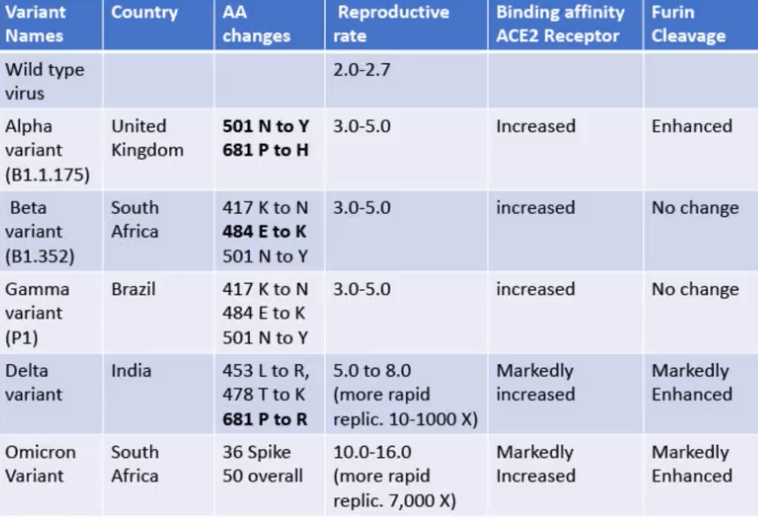
Variante inglese o del "Kent" (B.1.1.7 / Alpha)
Qualche dettaglio più tecnico (ma sempre soft, comprensibile anche ai non addetti ai lavori) sulla variante.
Tra le caratteristiche genetiche interessanti di questo ceppo, quella di veicolare 17 mutazioni (non polimorfismi) diverse.
 |
Le mutazioni, e loro localizzazione, presenti nella linea B.1.1.7
Credit: Andrew Rambaut et al (19/12/2020)
|
Aggiornamento. In data 1 febbraio le autorità UK hanno comunicato che alle precedenti mutazioni se ne è aggiunta una, E484K. Tale mutazione finora era caratteristica della variante sudafricana che pare diminuire l'efficacia del vaccino e degli anticorpi neutralizzanti.
La comparsa di un tale aggregato di mutazioni in un ceppo è in genere attribuibile ad una selezione avvenuta all'interno di un singolo individuo, piuttosto che all’accumulo di mutazioni nel passaggio tra un soggetto e il successivo. Le condizioni ottimali perché ciò avvenga si verificano (lo storico in altre infezioni lo dimostra) negli “infettati di lungo termine”.
La risposta immunitaria inefficace insieme al trattamento farmacologico (sia mediato da antivirali che con anticorpi/plasma dei guariti) mettono sotto forte pressione il virus; se il processo selettivo si protrae troppo a lungo (alias il virus sta resistendo e mantiene una cerca capacità replicativa seppure a livello basale) queste sono le condizioni in cui si accumuleranno le mutazioni capaci di conferire un vantaggio nella sopravvivenza.
Le mutazioni accumulate sono tali da renderlo più contagioso in assoluto o solo un epifenomeno frutto delle particolari condizioni in cui è sorto?
Supponiamo ora la nuova variante abbia effettivamente una maggiore capacità di trasmissione. In presenza di strumenti di minimizzazione del contagio (maschere, gel, distanziamento sociale, …) anche il possedere una proteina Spike migliorata non darebbe alcun vantaggio nella propagazione ... perché la variante non è il risultato di una selezione a renderlo capace di infettare più persone ma di sopravvivere all'interno di un individuo sottoposto a terapia.
Da cui l’importanza di queste barriere per tutelarci ed impedirne la diffusione
Analizziamo ora alcune delle mutazioni funzionalmente più interessanti tra le 17 presenti nella tabella. Non si tratta di mutazioni "uniche", ma già viste in altre varianti virali, sebbene mai insieme.
Cominciamo dalle 3 mutazioni che colpiscono la proteina Spike.
 |
Panoramica della posizione delle mutazioni nella proteina Spike (image credit: CeronLab)
|
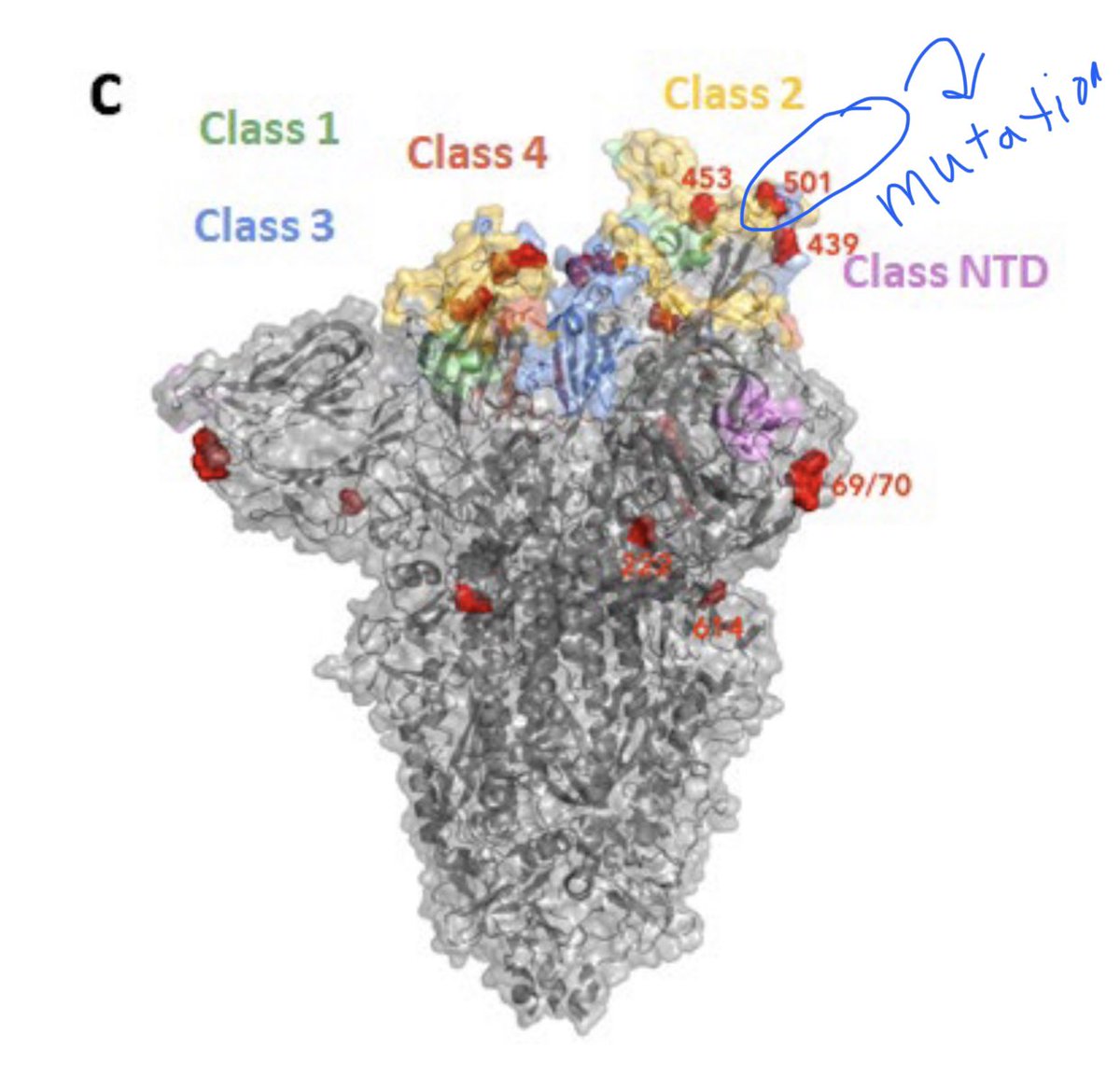 |
| Modalità alternativa (Surface) per visualizzare la struttura proteica, in questo caso risaltando l'esterno ma mantenendo in semi-opacità la sottostante struttura secondaria. | |
 |
Le 3 mutazioni caratterizzanti la variante inglese. La dicitura sulla figura è fuorviante in quanto la N501Y è una sola (in alto a dx) mentre le altre 2 sono le associate alla "variante inglese".
|
- 69-70del (H69/V70). Alterazione osservata nel contesto dell'evasione alla risposta
immunitaria. Si tratta di una delle numerose delezioni ricorrenti
trovate nel dominio N terminale di Spike, spesso associata a diverse
mutazioni nel RBD. Visto la prima volta nel visone (Danimarca),
associato alla mutazione Y453F, e negli esseri umani in associazione con
la mutazione N439K. La frequenza con cui compare questa delezione è stata spiegata con la particolare struttura del RNA in quella posizione che favorisce errori da parte della polimerasi (per altri dettagli "Recurrent emergence and transmission of a SARS-CoV-2 Spike deletion H69/V70")
- P681H Non sono a conoscenza di studi che hanno esplorato l'effetto di questa mutazione. Probabilmente non è casuale l'essere immediatamente adiacente al sito di taglio operato dalla furina (sul ruolo essenziale della furina vedi anche "Furin Cleavage Site Is Key to SARS-CoV-2 Pathogenesis"). Esperimenti in laboratorio hanno dimostrato che la perdita di questo sito favorisce la replicazione virale in alcune cellule ma la attenua nelle cellule respiratorie rendendola di fatto meno virulenta. Questo sito è assente in altri coronavirus e si ritiene che la sua comparsa sia stata una delle chiavi che ha consentito al SARS-CoV-2 un accesso facilitato alle cellule dell’epitelio respiratorio. Importante notare come la variante indiana abbia P681R che pare importante nella sua maggiore diffusione
Oltre a queste 3 mutazioni nella proteina Spike vale la pena citare le mutazioni nel gene
ORF8 in quanto la sua proteina è una delle proteine accessorie in più rapida evoluzione tra i beta coronavirus ed è stata precedentemente proposta come artefice dell’azione di interferenza con la risposta immunitaria dell'ospite. Come?
Diminuendo l'espressione del MHC-1 e interrompendo il segnale antivirale mediato da interferone-a (IFN-1). Una delle mutazioni presenti,
ORF8 Q27stop, produce una proteina tronca, inattiva. Il dato di mutazioni nonsense (o delezioni) in ORF8 in sé non è nuovo (vedi
F. Pereira - 2020) e segnala che il virus può continuare a diffondersi in assenza di questa proteina ma che rimane necessaria in talune circostanze.
Nota. 2 studi pubblicati su Science (Zhang et al. e Bastard et al.) fanno luce su un elemento chiave che potrebbe spiegare perché in alcuni soggetti, a parità di ceppo e dello stato di salute precedente l'infezione, il decorso della malattia sia più grave: la mancanza di IFN-1. Gli interferoni sono una famiglia di proteine che le cellule producono in condizioni di stress e/o quando rilevano virus. La loro carenza, spiegata da mutazioni ereditarie o ad autoimmunitarie contro gli IFN, abbassa le difese e favorisce l'aumento del titolo virale.
Un quesito spontaneo è quale possa essere il vantaggio di tali mutanti (o meglio della proteina in genere se non serve). Nel caso delle delezioni si pensa che favorisca la comparsa di hairpins che poi facilitano eventi di ricombinazione. La presenza di uno stop favorisce la comparsa di mutazioni carrier a valle del sito di stop che, in caso di mutazioni reverenti sarebbe già pronte all'uso.
ORF8 è presente anche nel virus della SARS ma le sequenze sono tra loro molto divergenti.
All'inizio della pandemia furono identificati ceppi mutanti a Singapore, privi di ORF8, associati a un'infezione clinica più lieve e a una minore infiammazione post-infezione. Queste varianti sono poi scomparse con l'aumento delle restrizioni per minimizzare i contagi.
Domanda. Le mutazioni a carico della RBD alterano la capacità di legare ACE2? Innanzitutto è implicito che tale alterazione non possa che essere positiva visto che mutanti "negativi" verrebbero controselezionati immediatamente. Da quanto ne so si ha un aumento di affinità nel caso di N501Y (Starr et al., 2020b), Y453F e N439K (Starr et al., 2020b; Thomson et al., 2020).
Riassumendo, i dati ad oggi disponibili ci portano ad ipotizzare che l'insolita divergenza genetica della linea B.1.1.7 sia il risultato, almeno in parte, dell'evoluzione del virus in un individuo che è rimasto infetto e in terapia per un periodo prolungato e verosimilmente immunodepresso. Sebbene tali infezioni siano rare e la successiva probabilità di trasmissione sia ancora più rara, tali eventi non sono improbabili dato il gran numero di nuove infezioni in corso.
Le mutazioni presenti sono coerenti con la possibilità che tale linea sia portatrice di una maggiore capacità di contagio (aumentata affinità per ACE2) e di evasione dal sistema immunitario; d'altra parte non ci sono evidenze né di aumentata virulenza né di problemi anche solo potenziali nella copertura vaccinale prossima ventura.
Aggiornamento giugno 2021.
Uno studio condotto alla UCL ha evidenziato che le cellule polmonari infettate da questa variante producono molto meno interferone del normale (e già sappiamo che il Sars-CoV-2 usa come strategia standard quella di colpire la produzione di interferone) e con esso i geni da esso attivati rimanevano "silenti". Questa variante virale ottiene questo risultato aumentando di 80 volte l'attività del gene virale Orf9b, la cui proteina interagisce con TOM70, una proteina cellulare chiave per la produzione di interferone. Il vero problema sembra tuttavia successivo: dato che l'interazione è reversibile, dopo circa 12 ore dall'evento il sistema di allarme torna "online" e questo provoca l'emissione di un segnale molto molto più potente del normale (si è accumulato), cosa che spiega la reazione eccessiva dell'organismo con uno stato infiammatorio sistemico. Non basta. La repentina risposta favorisce la comparsa di tosse e starnuti, che massimizza la diffusione di droplet e di muco infetto.
Sebbene anche le varianti sudafricana e indiana riducano i livelli di interferone, usano strategie che non coinvolgono Orf9b.
 |
| Come previsto dai modelli la variante inglese è diventata la dominante negli USA a fine aprile. Il fatto che in parallelo non si sia avuta una impennata di casi indica che il vaccino in uso protegge anche da questa variante. |
***
Variante sudafricana
Nome ufficiale B.1.351, 501Y.V2 o BETA
In comune con la variante inglese ha la mutazione N501Y. Di specifico le mutazioni E484K e K417N, site nella RBD della proteina Spike, che sembrano responsabili della capacità di questa variante di eludere gli anticorpi neutralizzanti (efficacia 10 volte inferiore).
Da notare che le mutazioni a carico di E484 sono quelle più efficaci nel minimizzare la capacità di riconoscimento da parte degli anticorpi neutralizzanti. Altri siti con simile rischio sono L455, F456, G485, F486 e F490. A conferma di tale "resistenza" ci sono i risultati del vaccino Novavax che mostra un crollo al 50% di efficacia nel "braccio" dello studio clinico condotto in Sudafrica.
Uno studio condotto in laboratorio usando plasma "immune" (lavoro
ancora in revisione) indica che questa variante è meno sensibile all'azione degli anticorpi neutralizzanti, sia quelli presenti naturalmente nei soggetti guariti che nelle persone vaccinate con Pfizer o Moderna. L'elemento centrale di tale "resistenza" sembra essere l'azione combinata sulla morfologia della proteina di E484K e le altre due mutazioni.
 |
Stesso discorso della figura sopra. La freccia indicante la posizione della E484K è solo quella centrale. Le altre frecce indicano le altre mutazioni presenti nel ceppo sudafricano.
|
EDIT 05/05/2021. Uno
studio pubblicato su The Lancet basato sull'efficacia del vaccino Pfizer in Israele mostra una protezione intorno al 95% dopo due dosi, confermata anche nelle aree in cui la variante B.1.1.7 è prevalente
Fonte
- Comprehensive mapping of mutations to the SARS-CoV-2 receptor-binding domain that affect recognition by polyclonal human serum antibodies
Variante brasiliana
Nome ufficiale P.1 o B.1.1.248 o GAMMA.
Manaus è considerato l'epicentro della variante.
La preoccupazione è nella mutazione E484 che la rende meno riconoscibile dagli anticorpi neutralizzanti. Un dato allarmante è che nonostante l'analisi sierologica avesse mostrato che ad ottobre il 76% della popolazione di Manaus era già stato infettato, questo non ha evitato che a fine dicembre si registrasse un picco di infezioni mai così alto. Le possibili spiegazioni vanno da errori nei test alla perdita di immunità sia per ragioni intrinseche alla durata degli anticorpi sviluppati che per l'emersione di varianti capaci di superare questa protezione
 |
| Ogni punto rappresenta un genoma SARS-CoV-2, mentre le linee indicano "il ramo" evolutivo. Al centro il genoma virale al momento del passaggio in essere umano. Più ci si allontana dal centro, maggiore il numero di mutazioni. Nella figura sono indicati per semplicità solo le tre varianti principali (Image credit: NextStrain via theconversation.com, CC BY) |
Variante californiana
Epsilon (B.1.427 e B.1.429)
La variante ha dato luogo a diversi grandi focolai nella contea di Santa Clara, appena fuori San Francisco; diversi studi recenti, ancora in via di pubblicazione, hanno suggerito che Epsilon è più infettiva (40% circa) rispetto ad altre varianti, e che sembra in grado di sfuggire con più efficacia alle difese del sistema immunitario.
 |
Per ulteriori dettagli vedi l'infografica sul sfchronicle
|
Il primo indizio di CAL.20C risale a luglio, rimasto come unico esempio fino a ottobre. Già a novembre aveva raggiunto il 25% dei campioni analizzati, il 36,4% ad inizio gennaio per arrivare al 50% di settimana scorsa (
10 gennaio).
 |
La variazione della frequenza relativa della variante in meno di 1 mese
(clicca QUI per l'intervista a Charles Chiu della UCSF)
|
Aggiornamento 02/2021
Alcuni dati indicano un maggiore rischio di ospedalizzazione e di entrata nelle ICU (e a cascata un maggiore mortalità) ma si tratta di analisi preliminari.
Quello che appare preoccupante è che la capacità degli anticorpi neutralizzanti di riconoscere questa variante è tra 2 e 4 volte inferiore il che si traduce nella probabile necessità di adeguare il vaccino.
Variante nigeriana (linea B.1.207)
Mutazione caratterizzante è P681H. Ad oggi sembra limitata e non mostra alcuna caratteristica peggiore rispetto alla B.1.1.7 da cui sembra essere derivata.
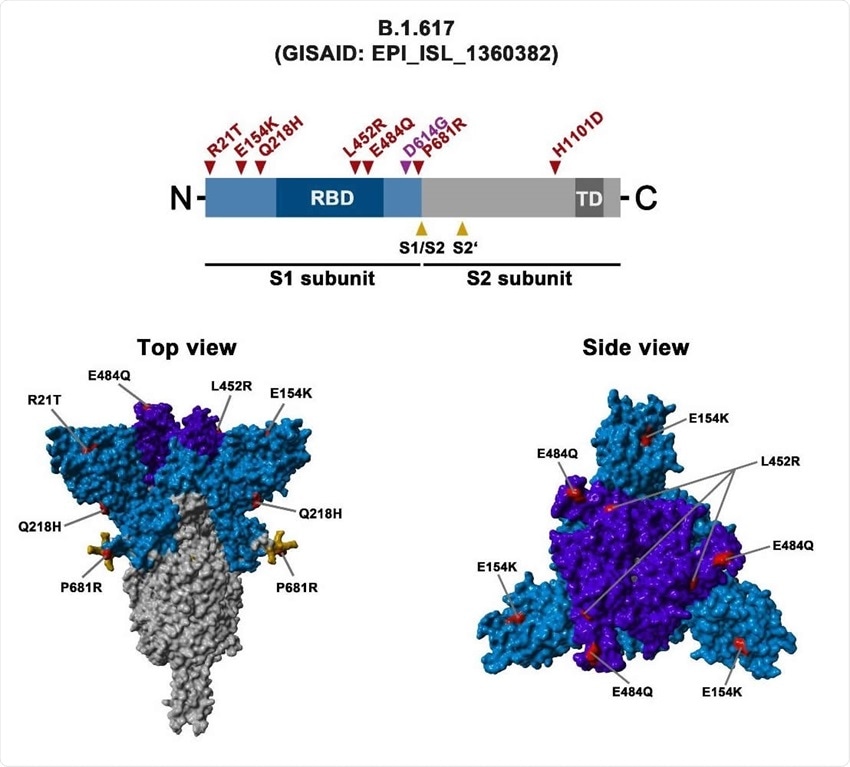
Variante indiana
linea B.1.617.2 o DELTA
linea B.1.617.1 o KAPPA
Caratterizzante è la presenza di entrambe le mutazioni
E484Q and L452R nel gene Spike.
Uno studio di aprile 2021 condotto su colture cellulari ha evidenziato una maggiore efficienza di infezione e un certo grado di capacità di evasione dagli anticorpi presenti nel cosiddetto plasma convalescente.
Ad oggi questa pare essere la variante con il più alto indice di trasmissibilità, responsabile sia della crisi in India che dei nuovi focolai nelle Seychelles (dove pur gran parte della popolazione è vaccinata) e a Taiwan. Il numero di casi riferiti a questa variante sta rapidamente aumentando in UK
 |
| India (credit: Victor Grubsky) |
 |
| UK (credit: Victor Grubsky) |
In India l'incidenza di questa variante è passata dal ~ 10% dei casi all'attuale ~ 80% nel giro di un mese. In UK si è passati da frequeze trascurabili a quasi il 25% dei casi in un mese. Il suo successo in UK è ancora più significativo perché
sta prendendo il posto della variante virale dominante (Kent o B.1.1.7) che partendo da qui si è poi diffusa nel resto del mondo grazie ad una trasmissibilità del 50% -70% superiore. Le attuali misure di prevenzione e vaccinazione sono efficaci per la variante B.1.1.7 ma la B.1.617.2 sembra non accorgersene.
A mia domanda diretta a Victor sui nuovi infetti la risposta è in un certo senso confortante in quanto si tratta di persone non ancora vaccinate. Rimane tuttavia da capire, e questo è molto complesso, se i vaccinati contraggano una infezione asintomatica della nuova variante che permette un certo grado di diffusione sotto traccia.
Le stime attuali indicano che la variante indiana diventerà dominante in UK ad inizio giugno.
Il caso Seychelles è però importante in quanto 1/3 dei nuovi casi aveva già ricevuto la doppia dose di vaccino; sappiamo che il 60% della popolazione vaccinata ha ricevuto Sinopharm e il restante AstraZeneca
(Seychelles brings back curbs despite vaccination success). La domanda spontanea è quindi se questo "buco" nella rete di protezione sia dovuto all'intrinseca minore efficienza di AZ e dei vaccini cinesi rispetto ai vaccini a RNA oppure se sia proprio il virus ad essere meno "visibile" al radar immunitario dei vaccinati tout court.
A metà 2021 luglio questa variante è oramai la dominante tra i nuovi casi diagnosticati in USA e UK.
La veloce diffusione di questa variante è un chiaro segno di un qualche vantaggio selettivo. Un
articolo in fase di revisione (luglio 2021) mostra che il tempo di latenza tra esposizione e rilevazione del virus è di 4 giorni vs. i 6 del ceppo originale (quindi maggiore velocità di replicazione) e un maggiore titolo virale nei pazienti (fino a mille volte superiore).
Lambda
linea C.37
Necessari ulteriori studi per confermare ipotesi di maggiore trasmissibilità e resistenza agli anticorpi neutralizzanti.
Delta Plus
Innanzitutto bisogna precisare che il nome "Delta Plus" era già stato utilizzato dai media per una diversa sottovariante di Delta. Un nuovo elemento di confusione causato da questa nomenclatura e da media poco attenti o competenti.
Ad oggi non ci sono reali segnali di una sua diffusione eccessiva. Ha suscitato però l'attenzione perché sembra essere aumentata di frequenza in alcune località.
Variante sudafricana 2
Segnalata per la prima volta il 24 novembre 2021 da un campione raccolto il 9 novembre.
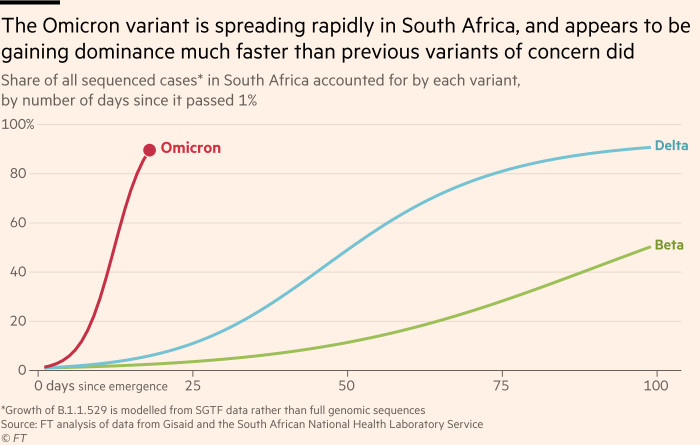 |
| La rapida diffusione della nuova variante in Sudafrica (credit:ft.com) |
La variante Omicron porta circa 50 mutazioni mai viste tutte assieme prima. Di queste 32 sono a carico della proteina Spike, alcune delle quali in grado definite preoccupanti per le caratteristiche conferite al virus. Ad esempio la D614G, N501Y e K417N sembrano aumentarne l'infettività. Per tale ragione è stata inserita nella tabella VOC.
 |
| Le mutazioni più rilevanti della variante Omicron (Image credit: ft.com) |
I test diagnostici in uso per il momento sono sufficienti alla sua rilevazione, importante per evitare falsi negativi.
 |
| Tabella comparativa mutazioni in 5 varianti (credit: E. Topol) |
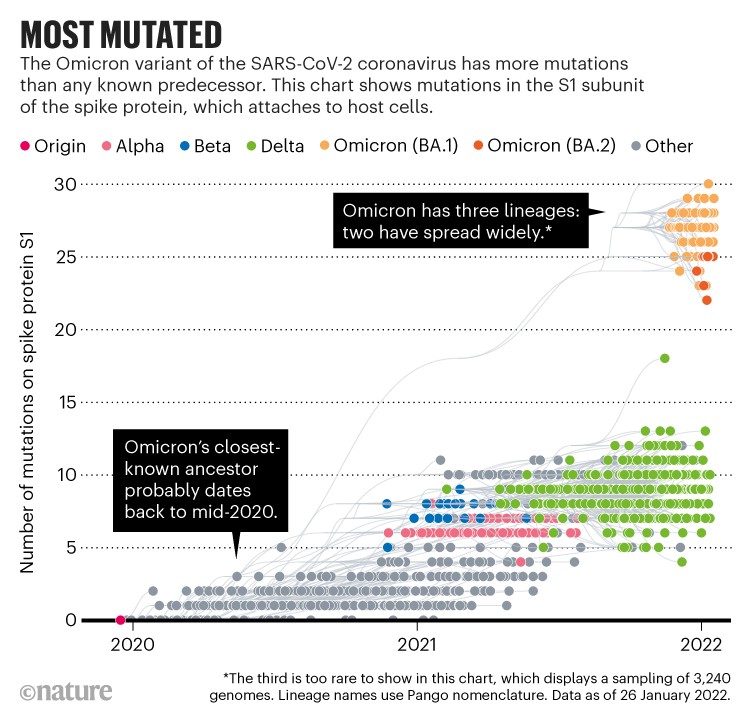 |
| Delle tre linee Omicron, la terza è molto rara (credit: Nature) |
Questa variante racchiude un mistero: com'è possibile che tutta questa serie di mutazioni sia passata sotto i radar per emergere all'improvviso?
I tratti genetici di Omicron hanno infatti più somiglianze con le varianti diffuse nel 2020 rispetto a quelle oggi dominanti come Beta e Delta.
Varie le teorie formulate. L'opinione più popolare tra i virologi è che le mutazioni si siano accumulate nel corso dei mesi in soggetti immunodepressi portatori di una infezione cronica. Secondo altri ricercatori la spinta decisiva è venuta dall'utilizzo dei farmaci antivirali, il che non sorprende se pensiamo all'impatto del trattamento antibiotico prolungato nella genesi di batteri resistenti agli antibiotici, a cui si sarebbe poi aggiunto un crossover del virus in un'altra specie animale prima di tornare agli umani.
Che questa variante sia comparsa in Sud Africa non sorprende data la diffusione del HIV che è responsabile di una immunodepressione cronica.
Da un punto di vista della virulenza i dati sono ancora insufficienti. Tuttavia due cose sono note: si
trasmette più facilmente della delta; predilige i bronchi invece dei polmoni il che potrebbe spiegare la maggiore facilità di trasmissione e anche la minore propensione a causare sintomi gravi.
Altra particolarità di Omicron è il percorso per entrare nella cellula
Se infatti la via classica è contatto con recettore che favorisce la fusione tra la membrana virale e quella cellulare, Omicron sembra preferire la via endosomiale come accadeva al suo "antenato", il virus SARS.
La capacità del sistema immunitario post-vaccinazione di neutralizzare la variante Omicron pur con tutte le sue mutazioni è attribuita alle difese cellulari più che a quelle articorpali. Vedi in proposito l'
articolo su Nature pubblicato a gennaio 2022.