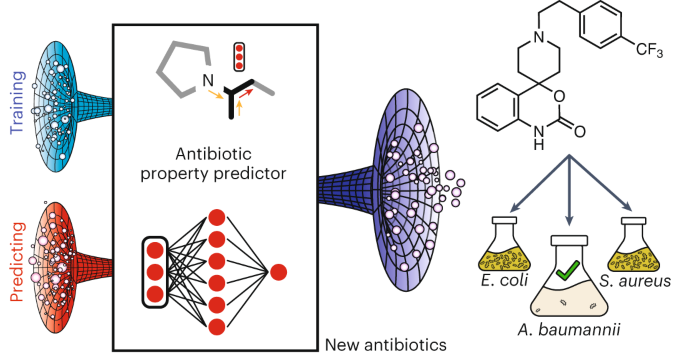
Di questi tempi va molto di moda prendersela con i microbi … e ci sono tutte le ragioni per farlo.
Basterebbe citare il coronavirus e batteri resistenti agli antibiotici per trovarci di fronte ad un bollettino di guerra in cui i caduti sono dell'ordine di decine di migliaia nei soli USA (la stima del CDC per la sola resistenza agli antibiotici è
1 decesso ogni 15').
Noi e i microbi creiamo un ecosistema
Senza i microbi noi non potremmo vivere e non mi riferisco solo al loro ruolo nell'ecosistema, ivi compresi i processi di biotrasformazione e dell'esistenza stessa dell'ossigeno nell'atmosfera (metà della produzione annuale
viene dal fitoplancton). Parlo dei microbi che vivono su e dentro di noi, dove "dentro" si riferisce all'epitelio delle cavità a diretto con l'esterno (ne ho parlato in un
precedente articolo).
I numeri del resto parlano chiaro
- mell'ambiente la biomassa di carbonio riferita ai microbi è pari a 93,2 gigatoni (1 gigatone =109 tonnellate) mentre l'essere umano è pari allo 0,05% della biomassa dei microbi.
- Nel corpo umano il rapporto tra il numero di nostre cellule e microbi è di circa 1 a 10 (tuttavia calcoli recenti sono più restrittivi, con un rapporto solo di 1 a 3). Ovviamente in questo caso "size matters", per cui il rapporto di massa si inverte: circa 1-3% della nostra massa corporea è batterico, che equivale a dire che ogni individuo di 90 kg si porta a spasso, principalmente sull'epitelio intestinale, 1 kg di microbi.
I microbi hanno un loro patrimonio genetico per cui possiamo anche pesare la quantità di informazione genetica tra i due "universi" coesistenti. Ebbene il 90% dell'informazione genetica è microbica (e questo senza contare i geni mitocondriali che come ho descritto altrove, hanno una remota origine batterica, essendo il
risultato di una simbiosi spinta all'estremo).
Nota. Anche se spesso usato in senso generico il termine microbioma indica in modo specifico la totalità del patrimonio genetico posseduto dal microbiota, la popolazione di microrganismi che colonizza un determinato luogo.
Un calcolo recente stima in
10 mila le specie microbiche che vivono nell'ecosistema "in/su" una persona normale. E non si tratta di una mera contaminazione ambientale con cui dobbiamo convivere.
Ne abbiamo bisogno.
Nota.
Sebbene il termine microbi riguardi tutto ciò che appartiene al mondo
microscopico e unicellulare (termini non sinonimi), quindi batteri,
lieviti, virus e protisti, in questo articolo lo userò per indicare principalmente i
batteri, seguendo il linguaggio "comune".
La riprova è sperimentale e osservazionale: gli animali nati e cresciuti in un ambiente asettico, sono meno sani e più inclini alle malattie autoimmuni e lo stesso vale per i
bambini costretti a vivere in un ambiente sterile a causa del loro sistema immunitario compromesso.
Una conferma indiretta viene dall'osservazione di bambini sani cresciuti in un ambiente eccessivamente sanitizzato, che mostrano un maggior rischio di allergie di coetanei lasciati liberi di "sporcarsi". L'ipotesi sottostante (nota come
ipotesi dell'igiene) è che i microbi "tengono in allenamento" il nostro sistema immunitario abituandolo a regolarsi; in loro assenza la risposta ad un allergene ambientale rischia di diventare "eccessiva" in quanto il sistema manca di "autocontrollo"; fenomeno questo, più che l'inquinamento, alla base dell'aumentata frequenza di allergie rispetto a 50-100 anni fa quando l'aria delle città in piena era industriale era nettamente peggiore.
In linea generale i microbi che ospitiamo svolgono un ruolo riassumibile in tre punti:
- la concorrenza locale tiene a bada i microbi patogeni, sia con una azione diretta (bloccati chimicamente dai vicini) che indiretta (competizione per nutrienti);
- producono sostanze nutritive che noi primati non possiamo produrre (vitamine e anti-infiammatori);
- digeriscono prodotti alimentari per "noi" indigeribili cedendoci, dopo il loro primo "assaggio", sostanze alla nostra portata (esempio classico il rumine degli erbivori che ospita batteri capaci di digerire la cellulosa, senza i quali il ruminante soffrirebbe di inedia anche se allevato su ricchi pascoli).
Quanto detto spiega come mai l'alterazione della nostra flora intestinale possa avere effetti importanti sul nostro benessere fisico (vedi anche la correlazione
flora intestinale e obesità) e psichico (
vedi articolo sulla serotonina e intestino). Una relazione tanto iimportante che quando decimiamo la popolazione batterica intestinale usando antibiotici ad ampio spettro si ricorre all'ausilio di
probiotici per ripopolare l'intestino.
Questo non vuol dire che i microbi sono per definizione
buoni. Sono semplicemente organismi con cui condividiamo l'ambiente e con i quali il nostro organismo attua un rapporto di vigilanza attiva: "
non invadere spazi che non ti sono propri, non provocare danni e io ti tollero". Se abbassi le difese anche il più innocuo dei batteri cercherà di godere dell'improvvisa abbondanza di nutrienti e inizierà a proliferare dove non dovrebbe. Esempio tipico sono le infezioni fungine di cui soffrono i malati di AIDS, il cui sistema immunitario non è in grado di esercitare una vigilanza attiva.
Esistono poi batteri con cui è "impossibile andare d'accordo" in quanto produttori di tossine e/o particolarmente virulenti. Microbi responsabili di patologie fatali in pochi giorni, se non trattate. In alcuni casi sono pericolosi anche da morti in quanto la azione patologica è mediata da tossine da loro prodotte e non dalla proliferazione batterica nell'organismo (esempio classico è il
botulino).
Gli antibiotici, l'arma definitiva?
Contro questi avversari temibili, capaci di trasformare una semplice ferita in un rischio letale, pensavamo di avere trovare il rimedio definitivo con gli antibiotici.
"Pensavamo", verbo declinato al passato.
C'è stato infatti un tempo in cui il problema pareva risolto. Parliamo di non tanti anni fa, inizio degli anni '50, quando la penicillina divenne IL prodotto presente in ogni casa, simbolo di emancipazione dalle infezioni.
Lo stesso Fleming in verità si avvide che i batteri potevano diventare resistenti all'antibiotico ma si pensò che il problema non fosse di immediata rilevanza e che lo si sarebbe potuto superare con la scoperta di antibiotici sempre nuovi.
Gli antibiotici possono essere di origine naturale (prodotti da altri microbi) o sintetica, ma hanno tutti in comune l'avere come bersaglio le funzioni essenziali di un microbo tale da bloccarne la proliferazione (effetto citostatico) o eliminarlo (effetto citotossico). Alcune di queste molecole hanno un'azione molto specifica (funzionano su un numero limitato di specie batteriche), altri hanno spettro più ampio e come tali colpiscono batteri "buoni" e "cattivi".
Sottolineo un aspetto importante:
gli antibiotici esistono da sempre in natura essendo le armi usate da alcuni microbi per attaccare un diretto concorrente, sia per eliminare la competizione che per nutrirsene. E' ovvio che
nel momento stesso in cui esiste l'arma inizia la selezione della contromisura che potrà neutralizzarla:
- mutazioni che rendono il bersaglio (tipicamente una proteina) invisibile/inaccessibile all'arma;
- la selezione di geni che codificano l'informazione per neutralizzare l'arma. Tipico esempio la produzione di beta-lattamasi con cui i batteri neutralizzano gli antibiotici della classe beta-lattamici come la penicillina
In situazioni standard i microbi "resistenti" sono meno di una piccola minoranza (quando pure presenti) della popolazione in quanto la resistenza, in assenza di pressione selettiva, non fornisce alcun vantaggio ai portatori. E la Natura agisce sul principio di parsimonia: assenza di vantaggio equivale a non selezione del carattere che si diluirà nel tempo fino a scomparire o rimarrà confinato in sottogruppi di microbi per pura statistica.
La situazione cambia
nel momento stesso in cui entra in azione l'antibiotico: ora solo i microbi resistenti sopravviveranno e prolifereranno, avendo anche il vantaggio di una concorrenza decimata. Il problema si aggrava a causa della capacità dei batteri (anche tra specie molto diverse tra loro) di scambiarsi pezzi di codice genetico, favorendo così la diffusione della resistenza ad un dato antibiotico a batteri mai venuti in contatto con esso.
Parafrasando Joker in
Batman:The Dark Knight "
Whatever doesn't kill you makes you stranger", esattamente ciò che sta accadendo con i microbi ora.
Un problema globale
È così che la resistenza agli antibiotici è passata in soli 50 anni da mera discussione accademica di eventi in natura a problema clinico su scala mondiale. Un problema che potrebbe riportare l'orologio dello tecnica medica allo stato in cui versava la medicina fino agli anni '30, quando anche banali ferite superficiali erano a rischio infezione (figuriamoci interventi chirurgici complessi).
Se la resistenza ad un antibiotico (o meglio ad una classe di antibiotici, come i lattamati) crea problemi, immaginate di dovere affrontare batteri resistenti a molti se non a tutti gli antibiotici noti (fenomeno etichettato come MDR da
multi-drug resistance). Questo è ciò che gli americani chiamano "
Super-bug", superbatterio, o con l'acronimo AMR (
antimicrobial resistance).
Non si tratta di una mera possibilità ma di dati ottenuti dalla pratica clinica corrente.
Cito alcuni esempi:
- ceppi
di micobatteri (XDR-TB) resistenti anche agli antibiotici di ultima generazione con la conseguenza di lasciare i medici
nelle stesse situazioni dei loro colleghi di fine '800 (quando fino a
metà anni '60 il consensus era che la TBC fosse una malattia del
passato).
- Enterobacteriaceae resistenti ai carbapenemi (CRE) in grado di uccidere, a causa della
refrattarietà ai trattamenti classici, circa la metà
dei pazienti con sepsi. Come nel caso della resistenza ai beta-lattamati anche qui la resistenza acquisita è data da un enzima, NDM-1, il cui coinvolgimento venne
osservato la prima volta nella Klebsiella pneumoniae, isolata da un
paziente svedese ammalatosi durante una vacanza in India (ND sta per New
Delhi, M-1 sta per "Metallobetalactamase-1")
- Il
Clostridium difficile è un batterio responsabile di diarrea e colite in circa mezzo milione di persone all'anno nei soli USA. La comparsa di ceppi resistenti agli antibiotici ha causato un aumento del 400% dei casi riportati.
- Circa
il 67% delle persone che si ammalano di febbre tifoide, causata da
Salmonella typhi hanno a che fare con ceppi resistenti ad almeno un antibiotico.
Il
Centers for Disease Control and Prevention (CDC) ha definito gli AMR "batteri da incubo", attivando un sistema di classificazione su 3
livelli (preoccupante, grave e urgente), in base a tre parametri come:
- gravità della malattia causata;
- frequenza con cui si verificano;
- velocità con cui si diffondono
Molti sono stati gli studi finalizzati a comprendere le cause della fulminea (pochi decenni) diffusione su scala globale. Queste le cause principali:
- il
basso costo di questi farmaci li ha resi accessibili a tutti e per
molti anni acquistabili senza alcuna prescrizione medica. Ricordo bene
quando da bambino ricevevo una spolverata di penicillina sui moltepici
graffi frutto delle escursioni in bici o delle interminabili partite a
calcio quotidiane. Più sono comuni gli antibiotici, più è probabile la
selezione di ceppi resistenti. Se a questo si aggiunge il non rispetto della posologia (molti smettono di assumerli non appena i sintomi diminuiscono o li assumono in modo incostante) il risultato è facilitare la comparsa della resistenza.
- Allevamenti
e fognature. Se negli ultimi 20 anni i paesi occidentali hanno
implementato norme sempre più restrittive sull'uso di antibiotici e
hanno imposto il trattamento delle acque reflue cittadine e (ancora più
importante) dagli allevamenti intensivi, queste norme sono carta bianca
in paesi, a parole, sviluppati come India e Cina che pianificano missioni lunari e sono incapaci di gestire norme di igiene basiche. L'India ad esempio ha
uno dei più alti tassi di AMR a causa del trattamento inadeguato delle
acque reflue, degli scarti ospedalieri, dei fanghi agricoli, del
deflusso dall'acquacoltura mentre la Cina (e alcuni paesi est -Europa)
lo hanno nel campo dell'allevamento (in cui si fa ampio uso di
antibiotici, pratica di fatto obbligata data la densità animale).
Limitandoci agli studi condotti in India, ne cito 3:
- Uno studio del 2017 ha dimostrato che nelle acque reflue oltre il 70% dei
ceppi di Escherichia coli, Klebsiella pneumoniae, Acinetobacter baumannii e quasi la metà dei ceppi di Pseudomonas aeruginosa erano
resistenti ai fluorochinoloni e alle cefalosporine di terza generazione.
- In
un altro studio, i noti Vibrio cholera e Vibrio parahaemolyticus, isolati dai gamberetti, molluschi e granchi in vendita sui banchetti dei mercati erano tutti resistenti all'ampicillina, mentre la resistenza al
ceftazidima variava dal 67 al 96%.
- Un
terzo studio ha dimostrato che le acque sotterranee e superficiali
utilizzate per scopi potabili e ricreativi mostravano che il 17% degli E. coli era resistente alla cefalosporina di terza
generazione. Un valore che arrivava al 100% su 283 isolati di E. coli da un fiume.
Sebbene
(come ho
scritto in precedenza) la "bomba" della diffusione dei
ceppi AMR si sia innescata con il crollo dell'URSS (e con esso il suo
sistema sanitario con conseguente penuria e non ottemperanza ai regimi
terapeutici completi fondamentali quando si segue un trattamento antibiotico), in
India il problema ha avuto origine diversa frutto del particolare
connubio tra società istruita e mezzi inadeguati. Qui il problema è che
chi cerca una consulenza medica per infezioni ad un livello superiore a quello di base, si vede prescrivere antimicrobici di ultima generazione ad ampio spettro per la mancanza di una
diagnostica adeguata volta ad identificare l'agente patogeno responsabile e
la sua suscettibilità ai farmaci. L'attitudine terapeutica diventa
quindi "
uccidili tutti se non sai qual'è il microbo responsabile" (e
magari si tratta di un virus …).
Se a questo aggiungiamo che l'India
manca degli obblighi nei controlli sui rifiuti prodotti dalle industrie
farmaceutiche locali (non poche e di buon livello) e che tali rifiuti vanno a contaminare
la rete idrica, i campi e i fiumi (in cui in tanti si immergono per
scopi rituali) il meccanismo di diffusione con moltiplicatore è evidente.
A questo aggiungiamo la comparsa di nuovi meccanismi di resistenza ancora poco studiati ma che contribuiscono alla diffusione dei ceppi resistenti. a livello globale, fenomeno massimizzato dalla rete di
trasporti che "non prevede passaporti per i microbi".
Il risultato è l'impossibilità di trattare anche le complicazioni infettive comuni (polmonite) oltre a quelle "di un tempo" come tubercolosi, gonorrea e malattie di origine alimentare. Non
solo microbi patogeni diventeranno sempre più difficili da trattare ma, cosa più preoccupante le malattie oggi trattabili o opportunistiche, rischiano di sfuggire dal
controllo medico.
Se non si comprende la genetica e la potenza della selezione naturale che guida l'evoluzione saremo destinati a farci male.
I
microbi sono in giro da più tempo di noi, circa 3,5 miliardi di anni, e sono
sopravvissuti a estinzioni di massa e alla comparsa di sempre nuovi avversari.
Non sono ancora qui per caso, evolutosi per resistere alle
minacce esterne; per sfidarli (sapendo che ci servono per
sopravvivere) dobbiamo agire in modo intelligente e questo vuol dire agire sui punti sopra elencati
In questa lotta potremo avere alleati inattesi, i
virus batterici. Organismi perfetti come arme antibatteriche in quanto mirate a ceppi particolari e in grado di coevolvere autonomamente per superare le contromisure di resistenza adottate dai loro bersagli, in una lotta che va avanti dall'inizio dei tempi sulla Terra.
L'anno scorso una chiara dimostrazione di efficacia dei batteriofagi nel trattamento di una infezione da micobatteri MDR in un paziente affetto da fibrosi cistica.
Altro esempio delle potenzialità insite nei batteriofagi, il loro utilizzo sul campo per il trattamento di una infezione intrattabile che aveva colpito il marito di una ricercatrice durante un viaggio in Egitto. Il resoconto delle procedure messe in atto è mirabilmente descritto nel libro "The Perfect Predator" (di Strathdee & Patterson) o se preferite in modo molto più condensato in un articolo su The Verge.
Affascinati dai microbi? Allora, il museo
Micropia, sito ad Amsterdam fa al caso vostro. Un luogo totalmente dedicato all'osservazione interattiva con il mondo microbico
Virus contro superbatteri
xxx
*** Virus "antibiotici" ***
(articolo originariamente pubblicato a dicembre 2012)
In un
precedente articolo accennavo ai virus batterici (
batteriofagi) e al loro potenziale utilizzo in sostituzione e/o in aggiunta alla terapia antibiotica standard.
Un argomento attuale, sebbene l'idea di usare i batteriofagi a scopo terapeutico risalga a diverse decine di anni fa, data la sempre maggiore diffusione di batteri multi-resistenti agli antibiotici; un problema causato dal prolungato errato utilizzo, nei tempi e nei modi, degli antibiotici (senza prescrizione, per tempi inadeguati e perfino per la terapia di malattie virali!!).
 |
| Il fago T4 in una immagine classica (®textbookofbacteriology.net) |
I batteriofagi sono virus ampiamente studiati grazie ad i lavori pioneristici di Frederick Towrt nel 1915 e di Félix d'Hérelle nel 1917. Si tratta di virus molto diffusi che svolgono una funzione duplice nell'ecosistema batterico: mantengono sotto controllo la popolazione batterica; favoriscono la trasmissione genica orizzontale (scambio di materiale genetico fra batteri). In effetti è in parte proprio grazie a quest'ultimo aspetto, e alla presenza di virus lisogeni (infezione non litica), che la resistenza agli antibiotici si propaga fra un ceppo batterico e l'altro.
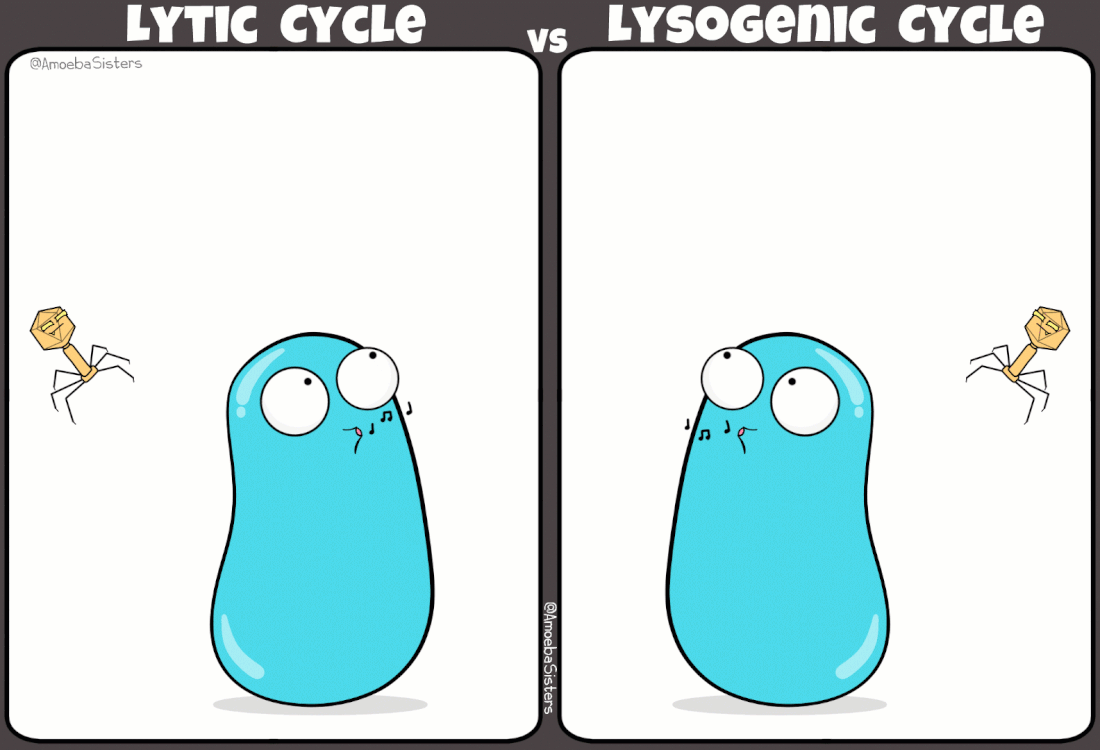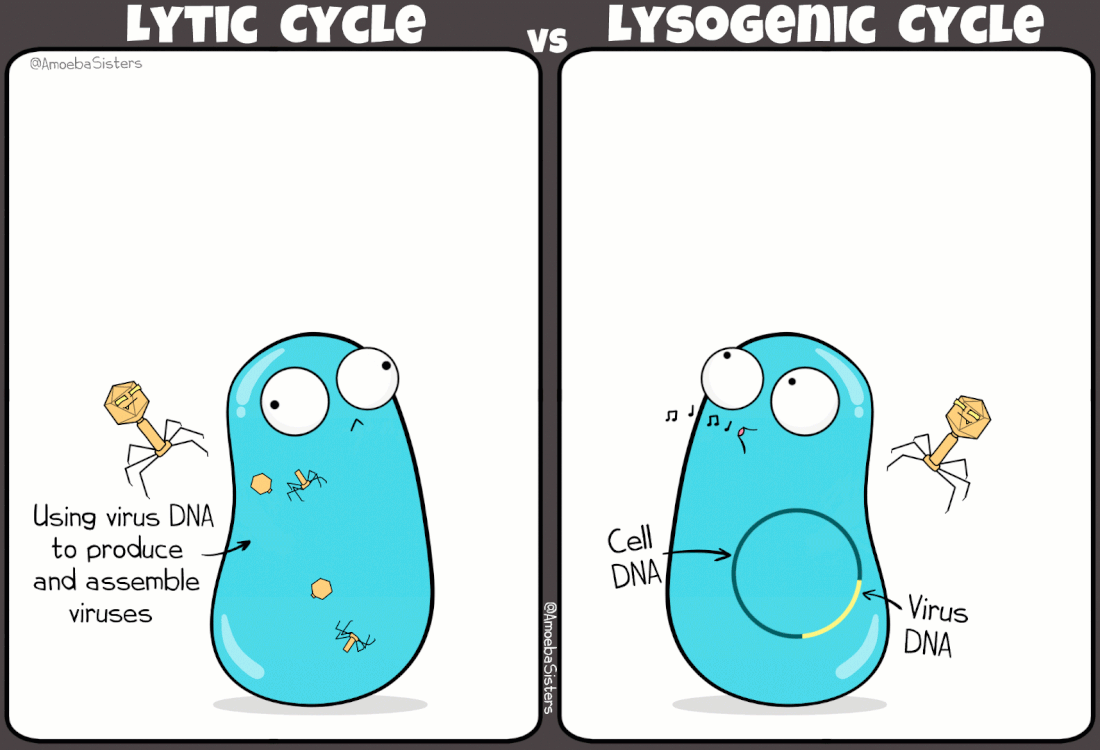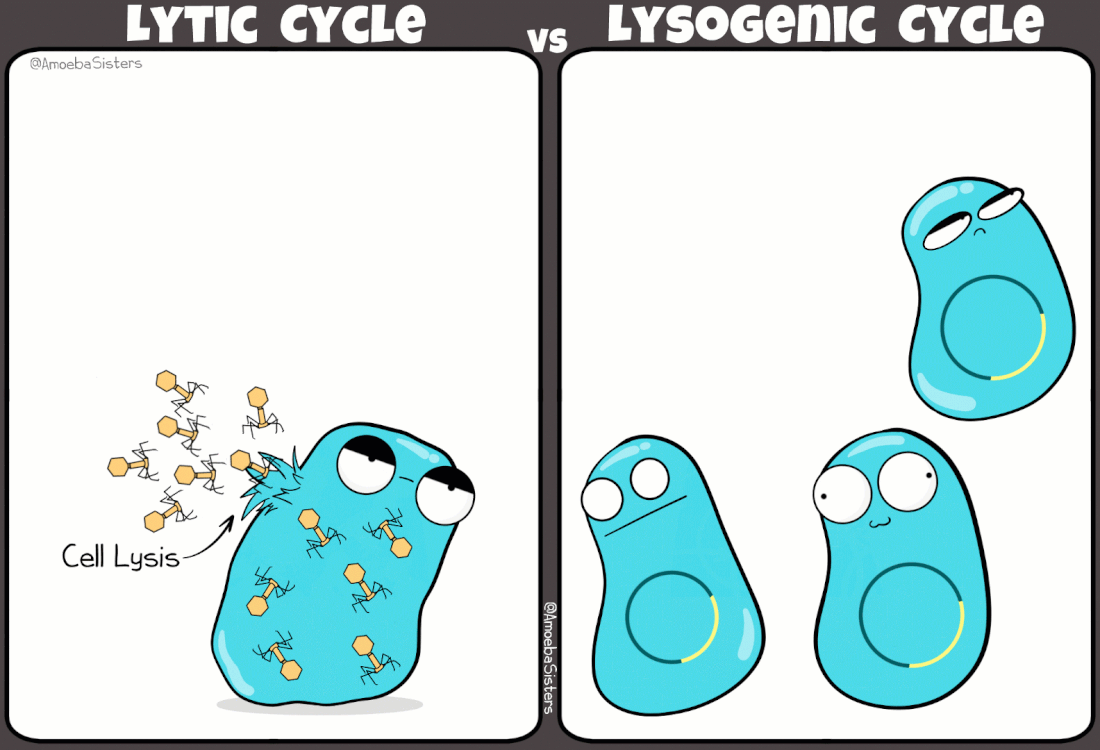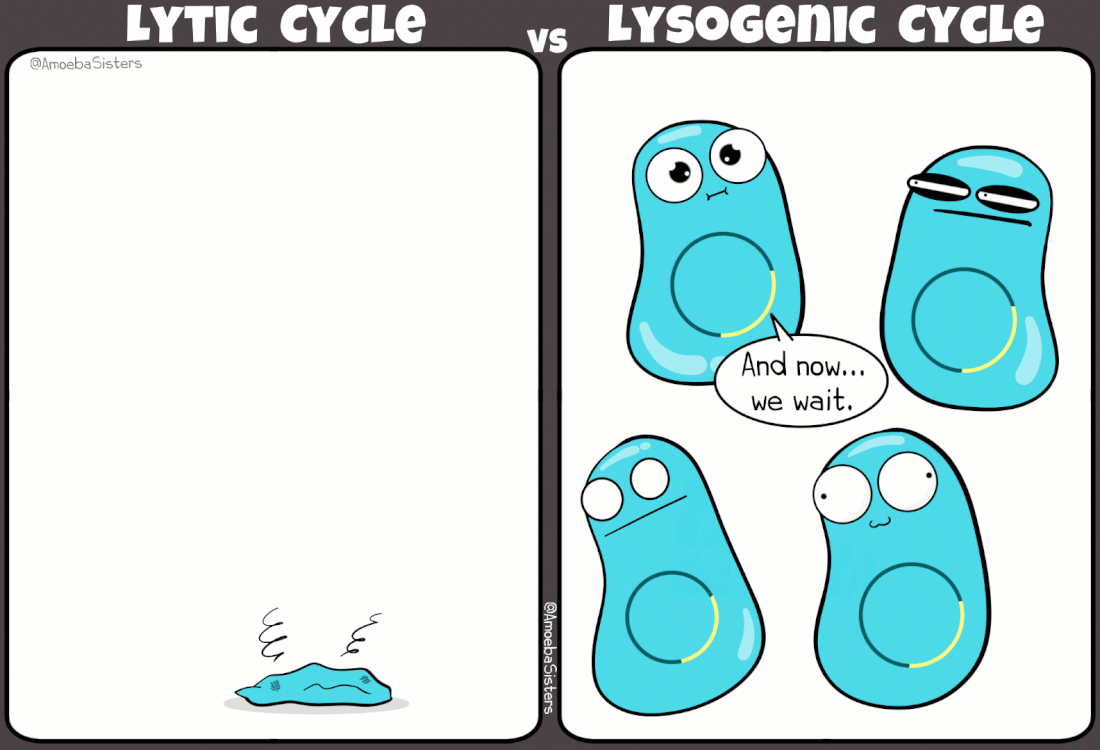 |
Simpatica comparazione tra ciclo mitico e ciclo lisogeno indotto da alcuni virus batterici
(credit: amoebasisters.com) |
 |
| T4 al computer (®cell.com) |
Attenzione però a non confondere la modalità della diffusione della resistenza con le cause che hanno permesso l'emergere della resistenza. La diffusione di un qualunque carattere associato ad un vantaggio selettivo è un processo del tutto naturale.
 |
| Batteri resistenti agli antibiotici (®USA Today) |
Il problema è a monte: per anni le persone hanno utilizzato male (leggi in modo inefficace o, peggio, inutile) gli antibiotici e tale cattivo utilizzo ha favorito la diffusione di ceppi resistenti; inoltre per sua stessa natura l'ambiente ospedaliero ha "concentrato" in un'area ristretta una massa critica di batteri resistenti che hanno avuto vita facile a scambiarsi le diverse resistenze prima e a diffondersi nei frequentatori dell'ospedale poi.
I virus batterici sono quindi il mezzo e non la causa prima della diffusione della resistenza. Questo loro aspetto neutro li rende all'opposto delle armi micidiali per invertire la diffusione dei batteri resistenti.
Come? Attraverso la diffusione di virus litici in grado di eliminare rapidamente e specificamente i batteri bersaglio; questo approccio permetterebbe di evitare gli effetti collaterali tipici degli antibiotici classici ad ampio raggio. I batteriofagi inoltre sono in grado di contrastare le difese che i batteri attivano mutando, attraverso un identico processo di adattamento.
Mentre scrivevo quest'ultima frase già immagino la domanda fatidica: "
.. e se poi il batteriofago muta e diventa capace di infettare l'uomo?".
Capisco l'obiezione ma è totalmente inconsistente per motivi spiegati nei corsi base di biologia (già al liceo):
un virus batterico NON può in alcun modo e qualunque mutazione acquisisca, infettare e tanto meno in una cellula eucariote (cioè funghi, piante, protisti, noi ... insomma tutto ciò che NON è procariote).
Una dimostrazione pratica senza tanti dettagli biomolecolari? Viviamo in un ambiente ricco di virus batterici; di più, ne ospitiamo un numero considerevole nel nostro intestino. Per loro noi "non esistiamo" in quanto non vedono proprio le nostre cellule. L'unico danno che un virus batterico potrebbe farci è essere così "di bocca buona" da fare fuori tutti i batteri intestinali. Il risultato sarebbe identico all'effetto collaterale di quando assumiamo antibiotici, cioè la necessità di assumere fermenti lattici per ricostituire la flora batterica
Torniamo allora all'idea di sfruttare i batteriofagi come nuovi antibiotici.
Una idea non nuova ma studiata negli anni '30 sia in Germania che in Unione Sovietica, poi abbandonata (tranne se non ricordo male in Georgia), perché meno conveniente rispetto agli antibiotici molecolari divenuti comuni alla fine degli anni '40.
Ma come dice Timothy Lu del MIT "ci sono oggi le condizioni per una rinascita dell'approccio fagico grazie alle tecniche di ingegneria genetica ora disponibili [e dalle necessità attuali]". "Tecniche" aggiunge Mark van Raaij del CNR spagnolo," che permettono di smontare e rimontare il fago a proprio piacimento".
Quali sono allora i problemi principali che frenano lo sviluppo?
- Il primo è di tipo economico. Le industrie farmaceutiche sono restie ad investire soldi in un'area in cui la possibilità di generare brevetti è limitata a causa della "notorietà" delle conoscenze associate. Ricordo che per depositare un brevetto la tecnologia proposta deve essere "nuova e
non nota alle persone del campo". Il che diviene problematico quando le conoscenze del campo si basano su innumerevoli studi condotti negli ultimi 90 anni. In altre parole no brevetti-no ritorno degli investimenti = investimento in perdita.
- Il secondo problema è legato alla approvazione degli enti regolatori. Né la FDA (USA) ne la EMA (EU) hanno elaborato un protocollo che consenta alle biotech di affrontare tranquillamente (cioè in modo da essere sicuri di non ricevere contestazioni da parte di tali enti) lo sviluppo di combinazioni fagiche necessarie per affrontare in tempi rapidissimi l'emergere di batteri resistenti (senza aspettare che si evolvano naturalmente).
Alcuni esempi applicativi
- nel 2009 Lu e Collins crearono un virus in grado di infettare batteri resistenti al quinolone; il virus modificato portava un gene che impediva al batterio di riparare i danni genetici causati dall'antibiotico. Il risultato fu impressionante: il trattamento virus più quinolone aumentò l'efficacia dell'antibiotico di 10.000 volte, di fatto impedendo sul nascere la comparsa di batteri resistenti (--> PNAS).
- Nel 2012 Udi Qimron della Università di Tel Aviv mostrò che aggiungendo un batteriofago modificato a batteri resistenti alla streptomicina e all'acido nalidixico diversi giorni prima dell'antibiotico, la sensibilità all'antibiotico veniva ripristinata. Grazie a questi dati Qimron sta ora pensando di trattare direttamente i ferri chirugici con i fagi. Questo approccio assicurebbe una efficacia pressochè totale al trattamento antibiotico standard di prassi dopo l'intervento. Oltre al vantaggio di efficacia questo approccio faciliterebbe il percorso di approvazione: non si tratterebbe più di fagi da somministrare ad esseri umani ma di un trattamento per gli strumenti medicali.
Quest'ultimo approccio si avvale del finanziamento fornito dalla Bill & Melinda Gates Foundation.
E siamo solo all'inizio
Aggiornamenti
2019. Un libro sulle potenzialità dei batteriofagi in clinica è "The Perfect Predator" di Strathdee & Patterson. Il lavoro a cui è ispirato è riportato in un articolo su The Verge.
2020. Un articolo divulgativo interessante sul newyorker
__________________
Articolo sull'argomento
Lauren Gravitz Nature Medicine 18, 1318–1320 (2012)