*** Il presente sostituisce in toto l'articolo del 16/11 ***
(Da questo momento gli aggiornamenti periodici verranno incorporati all'articolo con note a fondo pagina o alla fine di ogni "sezione")
Premessa
Prima di esaminare i vaccini bisogna rispondere a due domande chiave.
- È possibile raggiungere una copertura vaccinale in grado di conferire una herd immunity (sempre che sia possibile per i coronavirus; molti virologi ipotizzano a ragione la sua endemicizzazione)? La risposta non è assoluta ma dipende dalla comparsa di varianti (e dalla frequenza con cui compaiono) in grado di sfuggire al vaccino. In linea generale perché si abbia herd immunity è necessario vaccinare (o avere popolazione protetta da propri anticorpi post-infezione) una percentuale variabile a seconda sia dell'efficacia del vaccino che del valore di R0.
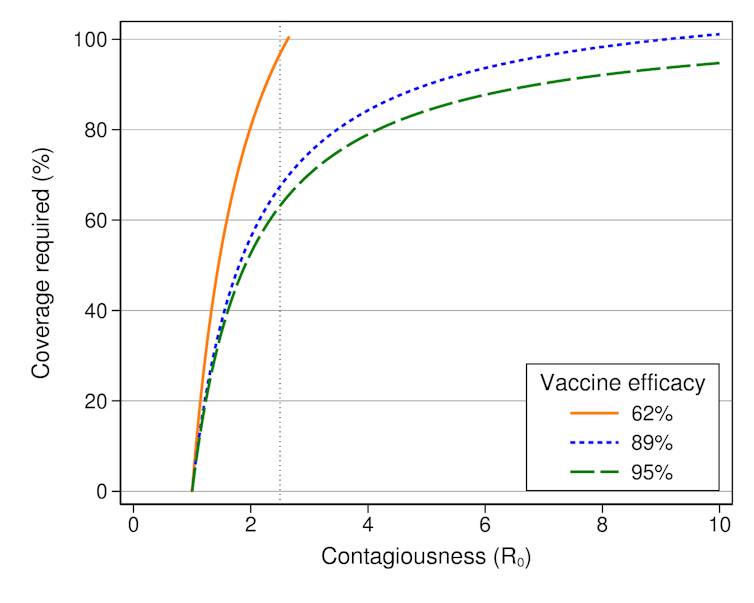 |
| Grafico che correla i valori di R0 con la percentuale di soggetti immuni (es. vaccinati) necessaria per raggiungere la herd immunity. Nel caso del covid19 la R0 è circa 2,5 mentre la Rt è ad oggi intorno a 0,95 (credit: theconversation.com) |
- Altro aspetto da capire è quanto tempo dura la protezione post-infezione (sintomatica o asintomatica che sia) o post-vaccino. Ad oggi sono 3 gli studi pubblicati su quanto dura la protezione dei vaccini anti-covid19. I dati sono concordi nell'indicare in almeno 8 mesi (quanto è durato finora lo studio) tale periodo sebbene questo non riguardi il 100% dei soggetti.
Di seguito i link ai 3 studi:
 |
| I sintomi più comunemente associati al covid19 |
Solo il tempo potrà rispondere a questi due quesiti. In assenza di herd immunity (copertura vaccinale insufficiente e/o varianti resistenti) dovremo preventivare un futuro fatto di outbreak stagionali come avviene con l'influenza.
I vaccini in sperimentazione/approvati
 |
| Credit: CDC/ A. Eckert, D. Higgins |
Negli stessi giorni in cui Pfizer/BioNTech e Moderna comunicavano i risultati di fase 3, sono stati resi noti anche i risultati preliminari del vaccino cinese (fase 1 e 2) e di quello di AstraZeneca che, per vari motivi sono in ritardo o appaiono meno soddisfacenti rispetto ai primi due. Va detto però che nello sviluppo di un vaccino non sono necessariamente i primi ad essere i migliori (quelli che poi diventeranno di uso comune) ma magari il 50mo vaccino prodotto. Solo i dati sul medio-lungo periodo ci diranno quali sono i "vincenti".
Guardiamo quindi ai dati disponibili, ora.
Cominciamo con uno sguardo al numero di vaccini in fase di sviluppo
Non solo Pfizer/BioNTech e Moderna. Ci sono altri vaccini, alternativi/complementari, in fase di sviluppo contro il Sars-CoV-2. Tra questi, oltre ai tre di cui scriverò ampiamente in seguito, cito quelli della tedesca
CureVac e l'AZD1222 di AstraZeneca.
Di seguito un grafico riassuntivo di tutti gli studi in corso
 |
L'articolo da cui ho tratto la figura fornisce un ottimo compendio di quanti e quali vaccini sono in fase di sviluppo (image credit & original article --> Vaccines in development (news.sky.com). Dalla figura si nota che quello di Pfizer non è il primo vaccino approvato per l'uso, primato che va ad un prodotto russo (nota. Approvato in Russia, non altrove, lo scorso agosto saltando a piè pari la fase 2). Secondo l'OMS sono 180 i vaccini in fase di sviluppo --> OMS.
|
|
La vera differenza tra questi è nella strategia seguita per indurre la risposta immunitaria preventiva (cioè capace di neutralizzare il coronavirus al primo accesso). Possiamo semplificare il tutto distinguendo varie vie:
- Classica 1. È il virus intero, inattivato o attenuato che sia, ad essere iniettato e come tale l'individuo ricevente lo "vedrà" e processerà per creare una "foto segnaletica" con cui istruire le pattuglie linfocitarie a riconoscere l'invasore in base a dettagli ad esso specifici. Vantaggio di questa procedura è il disporre di una foto segnaletica con molte più informazioni (rispetto alle procedure descritte poi), tale da sopperire ad eventuali mutazioni di alcune caratteristiche virali (se un gruppo di cellule non riesce più a riconoscerlo, quelle miranti ad altre caratteristiche dovrebbero continuare a funzionare). Due gli svantaggi principali di questo approccio: processo produttivo più complesso, sottostante a molti controlli di qualità per accertarsi che il virus usato sia inattivo (non sono stati usati virus attenuati per il covid19); maggior rischio di reazioni avverse al vaccino conseguenti ad una eccessiva risposta immunitaria. Questa è la procedura seguita dalle cinesi Sinovac e Sinopharm e dall'indiana Bharat.
- Classica 2. Invece di usare il virus integro si usano sue parti, in genere le proteine del rivestimento virale, prodotte in vitro, purificate e poi iniettate. Il vantaggio principale è la sicurezza assoluta (rispetto al precedente) nei processi produttivi legata al non maneggiare virus e quindi il minor costo complessivo. Svantaggio è nel non semplice controllo di qualità/scelta della proteina iniettata che deve essere immunogenica (spesso viene associata ad un adiuvante per massimizzare la risposta) e mantenere possibilmente la sua conformazione nativa per facilitare la capacità del sistema immunitario di riconoscere poi la proteina nativamente presente sul capside virale. Novavax si basa su questo approccio: proteine prodotte in colture cellulari infettate con baculovirus che esprime la Spike protein, che viene infine purificata, assemblata in nanoparticelle e infine usata per le immunizzazioni. EDIT: in data 11/03 sono stati resi pubblici i risultati degli studi clinici che mostrano per Novavax una protezione del 89,7% e nei restanti l'assenza di forme gravi del covid19.
- RNA. Si tratta della vera novità legata al vaccino contro il coronavirus. In sintesi (vedremo poi i dettagli) si veicola l'informazione genetica per produrre la proteina di interesse, sotto forma di mRNA, direttamente nelle cellule dell'organismo. Saranno poi queste a produrre la proteina che attiverà una risposta immunitaria in quanto non riconosciuta come self. La gran parte delle aziende in gara ha deciso di seguire questa strada, finora solo sperimentale, per una serie di ragioni tra cui sicurezza, velocità di produzione di milioni di dosi e costi contenuti a parità (o migliore) di efficacia. Non a caso i migliori vaccini per il covid19 finora emersi sono quelli di Moderna e Pfizer (CureVac è troppo indietro nella sperimentazione) tutti basati su RNA. Lo svantaggio di questo approccio è simile a "classica 2" nel senso che il bersaglio virale è una singola proteina (in genere la proteina S del capside. Vedi sotto perché si è scelta questa e non la proteina N).
- Vaccino virus ricombinante. Si utilizza una strategia ben nota a chi lavora nei laboratori di ricerca, cioè utilizzare come vettore un virus di altro tipo (non patogeno) in cui vengono rimosse alcune porzioni del genoma, sostituite con quelle del virus verso cui si vuole indurre la risposta immunitaria. Il virus iniettato infetterà le cellule senza produrre alcun tipo di progenie virale, producendo solo la proteina di interesse. Questa è la strategia usata da AstraZeneca, Johnson & Johnson e Gamaleya e Merck (basato sul VSV) per fare esprimere alle cellule del soggetto da immunizzare la proteina S. A gennaio Merck ha comunicato di avere abbandonato lo sviluppo di entrambi i suoi vaccini a causa di risultati di fase 1 inferiori alle aspettative.
- Cito qui solo per conoscenza anche la cosiddetta vaccinazione passiva, cioè quella "forzata" dall'esterno introducendo anticorpi capaci di neutralizzare il virus. Un approccio classico (mostrato anche in film classici come Virus Letale) ma che, come dice il termine non è una vera vaccinazione. Gli anticorpi possono essere originati dal siero di soggetti infettatisi e guariti autonomamente (che hanno quindi montato una risposta immunitaria efficace) oppure da anticorpi monoclonali (mAb) prodotti in colture cellulari. L'effetto protettivo è temporaneo (limitato alla emivita degli anticorpi iniettati) e limitato alla neutralizzazione dei virus circolanti, quindi utile dopo essere stati esposti al virus o con i primi sintomi e NON quando si viene ricoverati per l'aggravarsi delle condizioni (manca in toto la componente cellulare della risposta immunitaria). Fatta questa premessa il trattamento con mAb ha mostrato una capacità di ridurre l'ospedalizzazione negli infettati del 70% ma solo se preso in fase precoce (entro 7gg dai sintomi) e se rientrano nella popolazione approvata dalla FDA (+65aa o con sottostanti fattori di rischio salute). Nel momento in cui scrivo l'unico trattamento per il Covid19 autorizzato dalla FDA è quello basato sugli mAb prodotti dalle aziende Ely Lily e da Regeneron. In Europa non mi sembra che siano stati approvati per ragioni di costi associati e non per ragioni di funzionalità; mentre nel caso di Ebola sarebbero utili (alta mortalità e bassa infettività) nel caso di Covid19 (bassa mortalità ed alta infettività) il costo sottostante sarebbe troppo alto. In un comunicato di fine gennaio 2021, sia Regeneron che Lily affermano di avere ottenuto protezione completa (su un centinaio di volontari) dalla infezione sintomatica e di avere dimezzato il numero di asintomatici positivi.
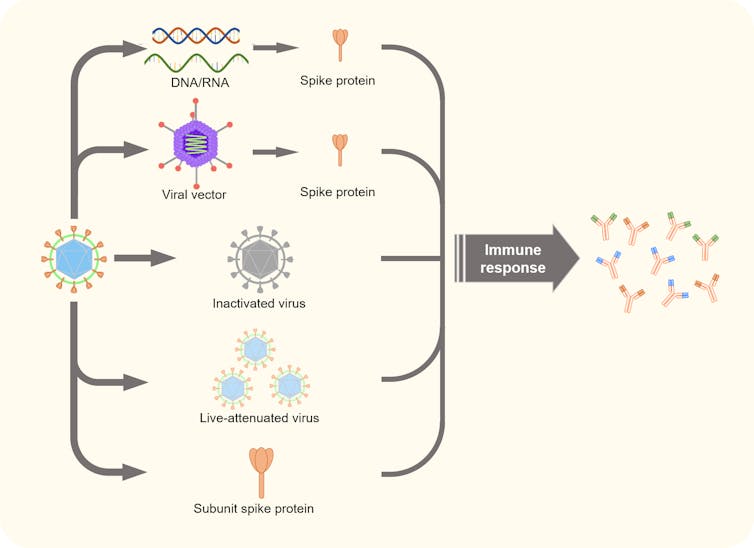 |
Riassunto degli approcci utilizzabili per preparare l'organismo a combattere il virus
(Image Credit: theconversation.com) |
Premessa indispensabile è che la piena approvazione e disponibilità di un vaccino Covid-19 potrebbe richiedere ancora mesi. Se tutto va bene i soggetti a rischio potrebbero riceverlo prima del nuovo anno mentre per tutti gli altri se ne parlerà tardo inverno, inizio primavera.
Ottenere un vaccino attraverso studi clinici e passare dalle forche caudine di FDA o EMA è un processo complesso, costoso e che richiede tempo (vedi in proposito la serie di articoli "Nuovi farmaci e costi connessi" che ne analizza i punti chiave). Inoltre la "mera" approvazione da parte delle autorità regolatorie è solo un passaggio per fare realmente arrivare un farmaco sul mercato (alcuni non ci arriveranno mai anche se formalmente approvati). Ancora di più nel caso di un vaccino come l'attuale con un problema di logistica legato al dovere essere disponibile in tempi brevi. Il piano allo studio da mesi dal governo federale americano, noto come Operazione Warp Speed, prevede uno sforzo finanziario di 10 miliardi di dollari, mirante ad assicurare 300 milioni di dosi di vaccino entro gennaio 2021 (anche se è probabile che i tempi possano essere posticipati di 1-3 mesi) e parlo solo del mercato USA.
Altro punto importante è che, almeno nel caso di Moderna e Pfizer (quelli che hanno completato la fase 3) si è usata la corsia accelerata per la valutazione dei risultati clinici (analisi
ad interim). La conseguenza è che oggi si può valutare SOLO la risposta immunitaria primaria, quella che genera la barriera anticorpale che dovrebbe minimizzare il rischio che il virus
attecchisca. Questo tipo di risposta fornisce in genere una protezione temporanea che può durare anche solo due mesi (non c'è nemmeno bisogno che il virus muti perché questa risposta si attenui, spesso basta un calo dello "stimolo" virale). La maggior parte dei vaccini oggi in uso si basa invece sulla attivazione della memoria immunitaria a lungo termine, quella che permette di fare si che tu debba essere vaccinato una sola volta (eventualmente con richiamo) per darti la protezione (sempre che il virus ovviamente non muti, come nel caso del virus influenzale). Per verificare se il vaccino è stato in grado di evocare una risposta immunitaria a lungo termine sono necessari 6-10 mesi di
follow-up, quindi nella migliore delle ipotesi si avranno questi risultati in tarda primavera.
Poi c'è la questione della sicurezza da considerare. Moderna, come Pfizer, afferma che il suo vaccino è stato generalmente ben tollerato durante i test clinici. Nel caso di Moderna, gli effetti collaterali riportati dal vaccino includevano dolori muscolari, affaticamento e mal di testa subito dopo la vaccinazione. Anche qui la procedura accelerata impedisce di valutare con certezza eventuali problemi sul medio periodo. Una preoccupazione, quest'ultima, in verità più formale che reale dato lo storico dei vaccini testati in questi anni (in genere se danno problemi lo danno subito); non a caso la FDA richiede solo due mesi di dati sulla sicurezza prima di rilasciare l'approvazione all'utilizzo per le situazioni di emergenza.
Ultima notazione quella riguardante una preoccupazione teorica, ma che NON poteva essere accantonata, per cui è stata attentamente valutata.
Rischio intrinseco di qualsiasi vaccino contro un nuovo virus (valido sia per vaccini classici che a RNA) è il fenomeno noto come
potenziamento dipendente da anticorpi (
ADE,
antibody-dependent enhancement) che è correlato (in modo ancora non del tutto chiarito) ad una eccessiva risposta infiammatoria. Sia chiaro,
questo non è un fenomeno associato alla vaccinazione ma avviene anche in natura con alcuni virus (vedi sotto) quando un individuo viene infettato nuovamente dopo essere guarito.
EDIT luglio 2020.
Una possibile spiegazione del fenomeno ADE è nella presenza, all'interno del pool anticorpale sviluppato dopo la prima esposizione, di anticorpi capaci di riconoscere il virus ma non "neutralizzanti. Il loro legame al bersaglio potrebbe infatti, paradossalmente, aumentare l'infezione permettendo l'ingresso in cellule immunitarie tipo i macrofagi che non sono il bersaglio naturale del virus. Un "corto circuito" mediato dai recettori per le Fc (le regioni costanti degli anticorpi) che sono usati da queste cellule per ripulire e processare tutto ciò che gli anticorpi indicano come "non self". Successivamente alla cattura i virus riuscirebbero a sfuggire dal fagosoma e inizierebbero a replicarsi dentro queste cellule aumentando così lo stato infiammatorio e il rischio di una malattia con sintomi più gravi.
L'esempio meglio noto è quello del virus Dengue responsabile della
omonima febbre. La prima volta che vieni infettato il decorso è tutto sommato lieve, in alcuni casi quasi asintomatico. Dopo il recupero, la persona è
protetta dall'infezione dai restanti 3 sierotipi di dengue per 2-3 mesi. Passato questo breve periodo, la persona è nuovamente sensibile all'infezione da uno qualsiasi di questi sierotipi e questa seconda infezione
ha un decorso peggiore a causa della suddetta ADE. Qualcuno ha ipotizzato che uno dei motivi per cui alcune persone, a parità di patologie pregresse, sperimentano una forma di covid19 molto più aggressiva è l'essere stati esposti in precedenza ad un coronavirus "simile che ha "settato" il sistema immunitario verso un attacco massiccio (e deleterio) per il successivo incontro con il virus (per semplicità,
ma sto estremizzando, possiamo pensare alla sensibilizzazione da puntura di ape che può indurre, in alcuni soggetti, uno shock anafilattico alla successiva puntura).
Ricordo che nei pazienti con sintomatologia covid19 più grave, questo stato NON è da attribuire (solo) all'essersi imbattuti in un ceppo molto virulento, ma alla eccessiva risposta immunitaria che provoca, in primis, il collasso della funzionalità polmonare, e in seguito un deterioramento sistemico.
Nessuno dei vaccini contro il coronavirus analizzati ad oggi ha evidenziato problemi simili.
Eccoci infine ai vaccini.
Inizio con l'ultimo arrivato, il vaccino cinese, in quanto basato sul metodo classico-1 e in fase clinica intermedia. Vedremo poi quello di AstraZeneca e infine i due vaccini a RNA di Pfizer e Moderna.
*** Vaccino "classico"***
(ad oggi solo quelli cinesi)
Nome (tradotto) dello studio: Sicurezza, tollerabilità e immunogenicità di un vaccino SARS-CoV-2 inattivato in adulti sani di età compresa tra 18 e 59 anni: uno studio clinico di fase 1/2 randomizzato, in doppio cieco, controllato con placebo.
Studio di fase 1 (sicurezza) e di fase 2 (sicurezza ed efficacia), condotto su adulti sani di età compresa tra 18 e 59 anni, reclutati nella contea di Suining (Jiangsu, Cina), non precedentemente infettati o esposti al SARS-CoV-2.
Il vaccino sperimentale usato è stato preparato in due modi diversi (a causa del diverso quantitativo necessario): mediante un processo di cell factory (Cina) per la fase 1 e attraverso un bioreattore (azienda svedese) per la sperimentazione di fase 2.
Il virus inattivato è stato prodotto in colture cellulari (linea Vero, originata da cellule renali di scimmia verde africana) esposte ad un particolare ceppo di SARS-CoV-2. Alla fine del periodo di incubazione, durante la fase produttiva del virus, il surnatante è stato raccolto, inattivato con β-propiolattone, concentrato, purificato e infine fatto assorbire su idrossido di alluminio, usato come adiuvante.
Il placebo è la soluzione diluente di idrossido di alluminio senza virus.
L'endpoint primario di sicurezza era la comparsa di reazioni avverse entro 28 giorni dall'iniezione nei soggetti che avevano ricevuto almeno una dose del farmaco in studio (definizione: popolazione di sicurezza).
L'outcome immunogenico primario era rappresentato dai tassi di sieroconversione degli anticorpi neutralizzanti contro SARS-CoV-2 al giorno 14 (coorte 0-14) o 28 (coorte 0-28) nei partecipanti che hanno completato il programma di vaccinazione a due dosi assegnato (popolazione per protocollo).
Disegno Fase 1
I test sono iniziati a fine aprile coinvolgendo (in modo progressivo, proprio per ragioni di sicurezza) 144 partecipanti. Al momento dello screening, i partecipanti sono stati inizialmente separati in due coorti, una delle quale prevede test e vaccinazione ai giorni 0 e 14, la seconda ai giorni 0 e 28.
All'interno di ciascuna coorte i primi 36 partecipanti sono stati assegnati al blocco 1 (dose bassa), poi altri 36 sono stati assegnati al blocco 2 (dose alta) e così via.
All'interno di ogni blocco, i partecipanti sono stati randomizzati perché ricevessero alcuni le due dosi di CoronaVac, gli altri due dosi di placebo.
Risultati fase 1
Incidenza delle reazioni avverse:
Coorte giorni 0 e 14: 29% (7/24, dose bassa), 38% (9/24, gruppo ad alto dosaggio), 8% (2/24, gruppo placebo),
Coorte giorni 0 e 28: 13% (3/24, dose bassa), 17% (4/24, gruppo ad alto dosaggio), 13% (3/23, gruppo placebo).
Sieroconversione degli anticorpi neutralizzanti:
Giorno 14 (gruppo 0-14): 46% (11/24, dose bassa); 50% (12/24, dose alta), 0% (placebo)
Giorno 28 (gruppo 0-28): 83% (20/24, dose bassa); 79% (19/24, dose alta), 1% (placebo quindi la sieroconversione era dovuta a contatto con virus "ambientale" e non allo studio)
Disegno Fase 2
Lo studio è iniziato a maggio dopo avere ottenuto i dati sulla sicurezza (fase 1). I 600 partecipanti sono stati suddivisi anche qui in 2 coorti temporali: trattamento nei giorni 0 e 14, o nei giorni 0 e 28.
I partecipanti sono stati quindi randomizzati in modo che, come sopra ricevessero il vaccino nei due dosaggi o il placebo.
Risultati fase 2
Incidenza delle reazioni avverse:
Coorte giorni 0 e 14: 33% (40/120, dose bassa), 35% (42/120, gruppo ad alto dosaggio), 22% (13/60, gruppo placebo),
Coorte giorni 0 e 28: 19% (23/120, dose bassa), 19% (23/120, gruppo ad alto dosaggio), 18% (11/60, gruppo placebo),
Sieroconversione degli anticorpi neutralizzanti:
Giorno 14 (gruppo 0-14): 92% (109/118, dose bassa); 98% (117/119, dose alta), 3% (2/60, placebo)
Giorno 28 (gruppo 0-28): 97% (114/117, dose bassa); 100% (118/118, dose alta), 0% (placebo)
Interpretazione
Tenendo conto della sicurezza, dell'immunogenicità e della capacità di produzione, la dose bassa di CoronaVac è la dose suggerita per la valutazione dell'efficacia nei futuri studi di fase 3.
In verità i vaccini "cinesi" sono almeno 2. Oltre a CoronaVac c'è Cansino (simile concettualmente al vaccino adenovirale di AstraZeneca) che è appena entrato in fase 3
[Aggiornamenti]
28 dicembre 2020. Un nuovo esempio di quanto questo approccio sia "vecchio stile" e poco conveniente viene anche dal costo del vaccino sviluppato: 6x più caro di quello di AstraZeneca e 1.5x di quello di Pfizer, con i suoi 60$ a dose]
12 aprile 2021. Il
capo dell'equivalente cinese del CDC ha confermato che i 4 vaccini made in China hanno una efficacia inferiore rispetto (poco superiore al 50%). Un rimedio suggerito è quello di creare mix con altri vaccini approvati in modo da massimizzare sia la copertura che l'efficacia).
***Vaccino virus ricombinante ***
(AstraZeneca, J&J, ...)
Come vettore si è utilizzato una versione attenuata del virus del raffreddore (adenovirus) incapace di replicarsi, in cui è stato inserito materiale genetico originato dal virus SARS-CoV-2 codificante per proteina Spike (S). Oltre al vaccino di AstraZeneca che descrivo sotto, gli altri 2 vaccini basati su un adenovirus inerte e modificato per produrre la Spike protein, sono quello di Johnson & Johnson e Sputnik (prodotto dalla russa Gamaleya).
La differenza principale tra questi è che AZ si basa su un adenovirus di scimpanzé (ChAdOx1), J&J sull'
adenovirus umano serotipo 26 (Ad26) e Gamaleya su 2 serotipi, Ad5 e Ad26 (nello specifico Ad26 la prima dose e Ad5 la seconda dose).
Tra tutti gli studi clinici questo di AstraZeneca (AZD-1222) è quello più "anomalo" a causa di errori procedurali che hanno imposto una analisi statistica un poco particolare. Ad un primo sguardo l'efficacia di protezione appare ben inferiore (70%) ai due vaccini Pfizer e Moderna (94%) ma se si analizzano meglio alcune coorti si scoprono valori intorno al 90%.
Cerchiamo di capire il perché.
Il totale di soggetti reclutati ammonta a 22690 divisi in due studi separati, uno nel Regno Unito e l'altro in Brasile. AstraZeneca ha raccolto i dati di entrambi gli studi in modo da avere numeri sufficienti per calcolare l'efficacia in modo statisticamente significativo. Grazie all'analisi combinata è stato possibile procedere all'analisi ad interim sull'efficacia del vaccino.
Il problema è che, a causa di un errore nel protocollo sperimentale molti soggetti hanno ricevuto un trattamento pari a mezza dose (prima somministrazione) e dose completa (seconda somministrazione) invece della classica 1+1.
Per questa ragione lo studio finale comprende 4 coorti di trattamento:
- la prima coorte (n = 8.895) ha ricevuto l'equivalente di due "dosi complete" a circa un mese di distanza;
- la seconda coorte ha agito come controllo per la prima coorte e ha ricevuto il vaccino meningococcico + placebo salino;
- la terza coorte (n = 2.741) ha ricevuto una mezza dose nella vaccinazione iniziale, seguita da una dose completa circa un mese dopo;
- la quarta coorte ha agito come controllo per la terza coorte e ha ricevuto il vaccino contro il meningococco + placebo.
Si sono contati in seguito il numero di casi covid19 nel campione in doppio cieco, confrontando i risultati tra chi aveva ricevuto il vaccino (e quale dose) e chi il placebo.
Se il calcolo della efficacia di protezione tra coorte 1 e 2, e tra coorte 3 e 4 è semplice, il calcolo dell'efficacia complessiva ha necessitato di bravi statistici.
La buona notizia è che tra coloro che avevano ricevuto il vaccino e che si erano ammalati di covid19 (n=131) nessuno ha avuto bisogno di essere ricoverato ad indicare un decorso facile anche nei casi di protezione parziale.
Se si analizza la protezione media complessiva dei due regimi di dosaggio, il valore è pari al 70%, significativamente inferiore ai risultati di efficacia per Pfizer e Moderna. Ma se si analizzano i risultati dei singoli bracci di trattamento, il regime a doppia dose piena mostrava un'efficacia del 62% mentre quello a "mezza dose + dose piena" una protezione del 90%. Da cui si può estrapolare che il secondo regime terapeutico dà valori paragonabili (inferiori del 5%) agli altri due ma con un grosso punto di forza: questo vaccino necessita di temperature di conservazione di solo 5°C (stabile per 6 mesi) rispetto ai -20 e -70 degli altri due (vedi di seguito i problemi che questo pone per la logistica) rendendolo ideale per l'utilizzo in zone "difficili".
Fonte:
- AZD1222 vaccine met primary efficacy endpoint in preventing COVID-19
[30/12/20]. Dopo una nuova analisi dei dati, AstraZeneca comunica che non è stato l'utilizzo di "1/2 dose + 1 dose" a generare il 90% di protezione ma il maggior tempo trascorso tra le 2 iniezioni. In particolare dalla comparazione tra due sottogruppi nella coorte vaccinata (diversi per tempo trascorso tra i due shots) si nota una protezione del 70% nel gruppo "12 settimane" e 90% nel gruppo "26 settimane".
Le autorità inglesi hanno fornito ad AZ una autorizzazione di emergenza per l'utilizzo del vaccino secondo un protocollo che prevede due dosi a distanza di un intervallo di tempo tra 4 e 12 settimane.
Fonte:
The Guardian
NYTimes
[01/02/21]. Uno studio
pubblicato su The Lancet ha esplorato la capacità protettiva del vaccino AZ nella modalità "singola somministrazione" ed un eventuale richiamo dopo 3 mesi.
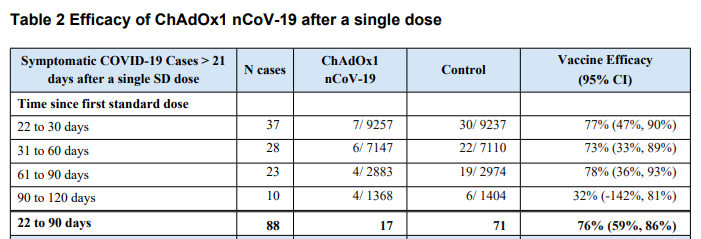 |
| Nonostante l'ampia barra d'errore il dato indica la fattibilità (in caso di mancanza vaccini) di procedere con singola dose. Fino a 3 mesi la protezione si assesta intorno al 76% (credit: The Lancet). Il vero limite dello studio è che la popolazione in esame è in gran parte giovane (86% sotto i 56 anni). |
76% vaccine efficacy against symptomatic COVID-19
100% efficacy against severe or critical disease and hospitalisation
85% efficacy against symptomatic COVID-19 in participants aged 65 years and over
[01/04/21]. Il percorso del vaccino di Astrazeneca (nuovo nome
Vaxzevria) è sempre più tormentato a causa di segnalazioni che arrivano da diversi paesi europei del rischio di effetti collaterali seri tipo trombosi in donne giovani e senza altre evidenti patologie. Bene precisare che parliamo sempre di numeri esiziali ma sufficienti, in mancanza di informazioni chiare, da indurre molti paesi a fermare l'utilizzo di questo vaccino. Secondo Alberto Mantovani (immunologo e direttore della Fondazione Humanitas) questi problemi potrebbero essere causati, secondo una
recente pubblicazione, dalla formazione di autoanticorpi: una condizione definita Vipt (
Vaccine induced prothrombotic immune thrombocytopenia), osservata in passato come effetto collaterale molto raro contro l'eparina.
Alla base del rischio trombosi e trombocitopenia potrebbe esserci
l'EDTA.[26/05/21]. Testata l'efficacia del vaccino AZ sulla variante B.1.351; il risultato è stato
pubblicato su NEJM. Su un campione di 2026 soggetti in Sud Africa, l'efficacia è intorno al 21,9% generale mentre è 10,4% sulla variante.
***Vaccini a RNA***
Passiamo ora ai due vaccini a RNA, sul quale ci dilungheremo un poco di più in quanto basati su una tecnologia/approccio meno conosciuti ai più, che possono essere sintetizzati con l'utilizzare le cellule dell'ospite stesso affinché producano la proteina (virale in questo caso) contro cui "programmare" la risposta immunitaria.
Prima di passare ai risultati dei 2 studi, una breve introduzione con le caratteristiche comuni a entrambi.
Il vaccino basato su mRNA
(messenger RNA), è già di per sé un dato interessante. Mentre i vaccini
convenzionali sono virus inattivati (un tempo si usavano versioni poco
virulente del virus) o le sue proteine, nel caso di un vaccino a RNA è
quest'ultima molecola che contiene le informazioni per la/e proteina/e
virali.
L'mRNA è (in genere) somministrato, mediante iniezione, incorporato in "veicolo"
di nanoparticelle lipidiche (LNP), facilmente assorbite e scarsamente
immunogeniche; caratteristica importante quest'ultima in quanto NON si
vuole innescare una risposta immunitaria contro il "veicolo" ma contro
l'antigene.
 |
Esempio di nanoparticella lipidica, simile a quella usata da Moderna, caricata del suo cargo (le molecole di RNA). In questo caso i lipidi carichi positivamente nella parte interna servono a stabilizzare l'acido nucleico (carico negativamente).
Image credit: Sei Yonezawa et al. (2020) .
|
I problemi teorici di questo approccio sono sia nel RNA che nel veicolo (nanoparticelle), i quali sono soggetti a deterioramento se non opportunamente conservati.
- Il primo vero problema è stato proprio lo sviluppo di un sistema affidabile e non tossico per veicolare l'RNA. Come vedremo poi uno dei punti chiave è stata la scelta di nanoparticelle lipidiche (particelle "piene") invece dei classici liposomi (cavi). Ma questo è stato solo il primo passo. Per ottenere nanoparticelle al cui interno l'acido nucleico (carico negativamente) fosse stabilizzato dall'interazione con il lipidi (di loro natura idrofobi) necessitava usare lipidi cationici (con estremità carica positivamente). Questi lipidi, non esistenti in natura ma facilmente sintetizzabili hanno un grosso problema: sono molto tossici perché funzionano come detergenti. La soluzione trovata negli anni fu nello sviluppo di lipidi cationici "condizionali", in cui la parte carica si palesava solo in condizioni acide mentre al pH del sangue erano neutri. Un trucchetto che insieme allo sviluppo di tecniche di microfluidica ha permesso di produrre in modo controllato e affidabile le nanoparticelle con all'interno l'RNA.
- L'RNA è una macromolecola labile dal punto di vista chimico a causa sia delle proprietà chimiche della sua struttura che della suscettibilità alle ribonucleasi. Tuttavia è possibile superare questi problemi di stabilità mediante sostituzioni chimiche appropriate.
- Le nanoparticelle con il tempo possono tendere all'aggregazione e al deterioramento. L'ipotesi generale è che il riarrangiamento del complesso mRNA-nanoparticelle lipidiche sia alla base della perdita di attività. I criopreservanti aiutano sicuramente, ma devi trovare il cocktail giusto per ogni tipologia di utilizzo.
 |
Ecco cosa capita conservando anche solo poche settimane le LNP in frigo. Problemi simili si hanno con congelamento e scongelamento.
|
 |
La dimensione delle LNP "ideali" perché siano catturate dalle APC ha dimensioni definite. Eventi di aggregazione le rendono "inutili"
|
 |
L'aggiunta di saccarosio o trealosio aiuta a preservare l'integrità delle LNP durante la conservazione e il congelamento.
|
Una
volta che il "cargo genetico" è stato consegnato alla cellula bersaglio
(la nanoparticella si fonde con la membrana e rilascia il suo contenuto
all'interno), la cellula decodifica la stringa di informazioni del mRNA
producendo la proteina, che alla fine va a posizionarsi nella parte
esterna della membrana cellulare, proprio come farebbe una cellula
infettata da un virus quando si prepara ad emettere la "progenie"
virale. Le cellule immunitarie nella loro incessante attività di
pattugliamento, rileveranno la proteina aliena (cioè non self)
che spicca dalla cellula, montando una risposta contro di essa. Posso ipotizzare che la risposta sia mediata da linfociti T helper e
nello specifico da Th2 (risposta umorale) più che Th1 (risposta
cellulare anticorpo mediata). La risposta mediata da Th2, grazie alla
produzione di citochine (IL-4, IL-5, IL-6, IL-9, IL-10 e IL-13),
garantisce la risposta di tipo umorale favorendo la produzione degli
anticorpi. Al contrario le cellule Th1 stimolano macrofagi, NK e
linfociti T CD8+ attraverso la produzione di IFN-γ e TNF-α.
Una ipotesi la mia
guidata dalla nozione che se è vero che nei pazienti affetti da covid19
si ha una diminuzione dei linfociti B, delle cellule NK e della conta
dei linfociti totali, sono le cellule CD4+ (rispetto alle CD8+) a subire
il calo maggiore. Un calo che ha valore prognostico in quanto un basso
livello di CD4+ predice sia la maggiore conta virale che una maggiore
probabilità di ricovero nei reparti di terapia intensiva; i pazienti più gravi presentano un aumento di monoliti, neutrofili ed eosinofili, livelli più elevati di cellule Th1 CD4+ rispetto ai pazienti con malattia moderata (questo pur in presenza di un calo simile nei valori di CD4+ e CD8+ Tc).
Da questo deduco che se si vuole predisporre il sistema immunitario ad
affrontare il virus in modo da non causare risposte deleterie (vedi
sotto), si dovrà agire limitando la risposta mediata da Th1. Possibile
in quanto l'espressione della sola proteina "aliena" nelle cellule trasfettate (che hanno catturato il nanosoma) non si associa alla emissione di segnali di pericolo (vedi danger model)
con i quali la cellula segnala di essere danneggiata o infettata. Tra
essi cito il recettore B7 che è fondamentale nel processo di attivazione
della risposta Th1 mediata; in sintesi se il TCR su una cellula Th si
imbatte in un MHC-I che porta l'antigene riconosciuto da quel TCR ma
manca l'interazione tra il B7 sulla cellula APC e il CD28 sul Th,
quest'ultima diviene energica, smette di partecipare alla risposta
immunitaria.
[edit dicembre 2020]. L'analisi del report Pfizer presentato alla FDA (qui il PDF) permette di avere un quadro più chiaro dell'approccio. Ad esempio si apprende che la risposta CD8 mediata è prevista, viene monitorata ed è considerata essenziale per l'eliminazione delle cellule infettate. Non contraddice quanto scritto sopra nel senso che la tossicità sistemica causata da Th1 si evidenzia durante l'infezione acuta del virus, mentre nel caso del vaccino si "prepara" l'organismo affinché possa da subito eliminare il problema, minimizzando così il rischio di risposte eccessive. Per approfondimenti sulla relazione tra gravità della malattia e livelli di citochine --> Cytokine profile and disease severity in patients with COVID-19.
Edit 2022. L'importanza della risposta cellulare (più stabile) rispetto a quella anticorpale nell'affrontare nuove varianti è discussa in un articolo su Nature.
L'attivazione
delle cellule Th2 attiva a sua volta la proliferazione dei linfociti B
che riconoscono quel particolare antigene virale e a cascata inizia la
produzione di anticorpi la cui presenza serve per neutralizzare il
virus, ricoprendolo, nel momento stesso in cui entra nell'organismo
(nota. Processo diverso dalla opsonizzazione, che si riferisce alla
eliminazione dei batteri ricoperti da anticorpi, principalmente IgG1 e
IgG3, grazie al richiamo del sistema del complemento e dei macrofagi).
Nota.
Il vaccino a mRNA fu pensato all'inizio come terapia contro il cancro
basandosi sul principio che se si fosse "convinto" il sistema
immunitario a riconoscere come "alieno" il pattern proteico tumorale (in
questo caso attivando una risposta Th1) le cellule tumorali sarebbero
state attaccate come estranee, quindi distrutte (ne ho accennato in un precedente articolo).
Successivamente si cominciò a lavorare per applicare questo tipo di
vaccinazione anche contro i virus (in primis influenza, citomegalovirus,
HIV, rabbia e Zika) ma è stato l'arrivo dell'uragano Covid-19 a dare la
spinta al processo grazie alle ingenti risorse, finanziare e
strutturali, messe in campo.
Per
contro questo tipo di vaccini sono in genere sensibili alla temperatura
di stoccaggio. I frammenti di RNA sono delicati e possono
degradarsi rapidamente, anche a temperature refrigerate. Ecco perché
congelarli alla temperatura appropriata è così importante (vedi sotto,
il paragrafo dedicato alle differenze di conservazione tra i vaccini
Pfizer e Moderna).
L'analisi che segue è semplificata e basata sui dati disponibili. I dati completi sono accessibili oggi solo alle autorità regolatorie che dovranno decidere se la decisione della azienda di passare direttamente alla richiesta di approvazione (prima della fine di fase 3 e senza un follow up sulla mid-term protection) siano motivate.
Nota. Il procedimento è comune quando durante uno studio clinico, i dati sono fortemente indicativi di un risultato (positivo o negativo che sia). In questi casi si procede ad una analisi ad interim dei dati; se statisticamente fondati lo studio clinico viene interrotto in modo da passare direttamente alla fase successiva (o fornire il trattamento in uso anche al campione di controllo che riceveva il placebo). Questa "scorciatoia" riguarda in genere farmaci progettati per malattie prive di un trattamento efficace, gravi e che colpiscono un numero elevato di persone.
Passiamo ora ai due studi, in ordine cronologico di divulgazione dei risultati.
Vaccino BioNTech / Pfizer (Comirnaty)
Nota 1. Vaccino approvato dalla FDA in data 8/12/2020 per uso su over-16
Nota 2. In data 31/03/21 Pfizer ha comunicato i risultati preliminari dello studio sugli adolescenti. Efficienza prossima al 100%
Il comunicato ufficiale risale ad inizio novembre ed è sintetizzabile con una protezione del 90%.
Nota. 1 settimana dopo il primo comunicato (e pochi giorni dopo che Moderna aveva mostrato il 94,6% di protezione, vedi fondo pagina per i dati a 6 mesi) ecco la correzione di Pfizer con i dati "definitivi" che alzano la soglia di efficacia ad un curioso 95% (0,4 sopra Moderna) nel campione over-65. Una correzione dei dati sicuramente fondata ma che potrebbe essere anche dovuta ad una rimodulazione del campione in esame. Per capirci sia i numeri del campione (passati da 64 mila a 44 mila), l'accento (comprensibile) sugli over-65 e la tempistica (subito dopo il successo azionario di Moderna) mi fanno sospendere il giudizio anche se non ho dubbi di correttezza al riguardo (e la statistica, bellezza!), solo l'avere ottenuto dati completi. Nei paragrafi successivi mi riferirò quindi SOLO ai primi dati emersi, piu che sufficienti per il mio scopo: spiegare i risultati e l'approccio usato.
L'RNA del vaccino di Pfizer codifica per la proteina S (spike), parte del rivestimento esterno della particella virale. Perché proprio la proteina S e non, ad esempio, quella nucleocapsidica (N)? Vedi nota2 a fondo pagina.
Ogni dose del vaccino contiene 30 microgrammi di RNA, incorporato nelle nanoparticelle lipidiche (fornite da
Acuitas Therapeutics e assemblate
nelle strutture dedicate che Pfizer/BioNTech hanno predisposto negli
Stati Uniti e in Europa). La versione di mRNA selezionata per la fase
finale dello studio clinico (fase 2 e 3) è la
BNT162b2, codificante per la proteina S nella forma nota come
prefusion spike glycoprotein.
 |
Il nanosoma lipidico prodotto Acuitas (all credit to acuitastx.com)
|
Lo studio clinico
I circa 64 mila volontari sono stati divisi in 2 gruppi (gruppo di controllo a cui veniva dato un placebo e gruppo test che ricevevano il vaccino) con la procedura del doppio cieco, il che significa che né i partecipanti né i medici sapevano se il trattamento somministrato fosse il placebo o il vaccino.
Ciascun partecipante ha ricevuto due dosi di trattamento e a partire dal settimo giorno dalla seconda dose si è monitorata la comparsa di malati.
Ricordo che le persone reclutate sono state scelte in modo da essere rappresentative della popolazione di provenienza, con la quale condividono il rischio contagio. Il razionale dello studio era verificare se le persone che avevano ricevuto il vaccino, una volta rientrate nella loro routine quotidiana, mostrassero un rischio malattia diverso (sperabilmente inferiore) da quelli trattati con il placebo (il cui rischio era per definizione identico a chiunque non avesse partecipato allo studio)
I dati indicano che a partire dal settimo giorno si sono avuti 94 positivi tra i partecipanti, il 90% dei quali apparteneva al gruppo di controllo; il che spannometricamente vuol dire 86 positivi nel gruppo di controllo contro 8 del gruppo vaccinato. Da quanto emerge dal protocollo, il follow up è stato fatto monitorando la comparsa di sintomi e non l'eventuale positivizzazione di soggetti altrimenti asintomatici. Comprensibile da un punto di vista operativo ma è un piccolo vulnus.
Detto in parole semplici se il vaccino non avesse funzionato, dei 94 positivi, 47 (con un delta di variabilità) avrebbero dovuto appartenere al gruppo test. |
| Tabella riassuntiva sulla capacità protettiva dei vaccini disponibili |
I numeri sono molto buoni ma rimangono nella mia mente alcune domande, ancora senza risposta (domande che possono essere estese anche allo studio di Moderna). Alcune di queste sono tali per assenza di informazioni complete (solo chi sta analizzando il dossier le possiede), altre per la durata ancora breve dello studio clinico:
- l'endpoint è lo stato di positività che qui viene fatto coincidere con la sintomaticità e non la presenza del virus in soggetti altrimenti asintomatici. Una scelta (obbligata per ragioni pratiche) che fa perdere gli asintomatici il che determina un certo bias nell'analisi. Se perdi i positivi non sintomatici c'è il rischio teorico di avere in giro super-diffusori vaccinati il cui rischio ricadrebbe sulla popolazione non vaccinata e sul 10% di vaccinati destinati ad ammalarsi (Nota, il punto 8.1 del protocollo indica che si procede alla sola conta dei sintomatici). Anche Moderna ha seguito la stessa via, per cui i due risultati sono tra loro comparabili.
- La non positività implica infezione sotto il livello di soglia oppure protezione assoluta? Parte della risposta viene anche dalla conta del numero di soggetti che sono diventati positivi poco tempo prima di ricevere la seconda dose e che (per protocollo) sono stati esclusi dallo studio.
- Dal momento della seconda dose al settimo giorno in cui sono comparsi i sintomi, quale è la finestra di protezione? Sarebbe stato interessante avere un gruppo di controllo che aveva ricevuto solo la prima dose per vedere se esisteva un differenziale di protezione tra le due coorti nella prima settimana dopo la seconda dose.
- Quanto dura la protezione? Domanda non peregrina se si pensa che il raffreddore da coronavirus (responsabile nell'adulto del 7-26% delle affezioni del tratto superiore dell'apparato respiratorio) non si associa ad una efficace protezione immunitaria post evento. A memoria ricordo un dato per cui nei bambini sono stati verificati fino a 3 episodi successivi nelle stesso mese di raffreddore causato dallo stesso virus (o forse da serotipi diversi dello stesso virus?). Una parziale risposta a tale quesito l'ho fornita nell'introduzione con i tre studi che hanno monitorato la permanenza dell'immunità nei soggetti guariti. Altro esempio quello del vaccino influenzale che fornisce una copertura di circa 4 mesi. Questa è la ragione per cui se (come tanti poco furbamente avevano proposto) si fosse deciso di anticipare a settembre la vaccinazione, si sarebbe creata una finestra di sensibilità già a fine gennaio/inizio febbraio (vedi in proposito uno studio del 2017). Un recente articolo di ricercatori di Oxford (fatto monitorando migliaia di operatori sanitari) sembra andare contro alcuni precedenti report mostrando che gli anticorpi anti-SARSCoV2 (indice di precedente esposizione al virus) rimangono in circolo per almeno 6 mesi.
- Ad oggi non sono state segnalate criticità legate alla ADE.
Nota 1. Gli stabilimenti produttivi di Pfizer e BioNTech in USA e Europa saranno in grado di preparare 1,35 miliardi di dosi entro la fine del 2021
(ovviamente se il vaccino verrà approvato) con un costo di circa 19 $
a dose. In questi casi non reputo corretto indignarsi per un prezzo
intrinseco accusando Pharma di speculare. Sia perché la stessa cifra
viene spesa per il gadget inutile di turno (e dove non possibile paga lo
stato) che per una ragione ovvia: se una azienda perde oggi i soldi
immessi nel processo di R&D, domani non parteciperà più allo
sviluppo di farmaci che la mandano in perdita.
Nota 2. La scelta di usare come induttore immunitario la proteina S
invece della N viene dalla maggiore specificità della S in quanto meno
simile alla analoga proteina del virus SARS: 90% omologia nel caso
della N, 77% nel caso della S (valore che scende al 66% nel caso della
subunità S1, la porzione di Spike che contiene il sito di legame ad ACE2 e che viene "liberata" dopo azione proteasica subito dopo il legame). Gli anticorpi "naturali" con maggiore efficacia
neutralizzante sono quelli contro la proteina S e sono sufficienti ad
impedire l'aggancio del virus alla cellula.
Aggiornamento: 12/12/2020
Alcuni numeri:
- Il vaccino inizia a funzionare 14 giorni dopo la prima dose
- Tra la 1a e 2a dose la protezione è 52.4%
- Nei primi 6 giorni dopo la seconda dose è 90%
- 7 giorni dopo la seconda dose è 95.1%
Nessun dato (sperimentazione non fatta) su eventuale rischio per:
- bambini fino a 11 anni
- donne in gravidanza o in allattamento
- persone con sistema immunitario deficitario
- persone con allergie medie o di grave entità
Mancano inoltre tutti i da sul lungo periodo (per ovvie ragioni).
Alcuni
dati provenienti da Israele indicano che la singola dose di vaccino Pfizer conferisce una protezione inferiore rispetto alle attese. Questo dato arriva in quasi contemporanea con la decisione, sopra menzionata, della
CDC di autorizzare l'utilizzo, in caso di necessità, di vaccini diversi per la seconda dose sebbene tale combinazione non sia mai stata testata.
"incidence rate dropped from 91.5 per 100,000 person-days to 3.1 per 100,000 person-days in fully vaccinated individuals which translates to a 95.3% efficacy. Vaccine shows good coverage against the B.1.1.7 variant."
***
Vaccino Moderna (mRNA-1273)
(edit: vaccino approvato dalla FDA per uso su over-18)
Se i dati saranno ritenuti statisticamente validi dalla autorità
regolatorie, le vaccinazioni potrebbero iniziare nella seconda metà di
dicembre, con la precedenza data ai gruppi ad alto rischio (operatori
sanitari, anziani e persone con patologie pregresse) mentre il resto
della popolazione dovrebbe riceverlo entro la primavera.
I risultati molto positivi, indicano una efficacia stimata intorno al 94,5%.
La sperimentazione in fase avanzata del vaccino Covid-19 di Moderna
Therapeutics è iniziata alla fine di luglio, un traguardo notevole se
si pensa che la fase 1 era iniziata a marzo.
Tipologia di vaccino (a RNA), di bersaglio (stabilized prefusion SARS-CoV-2 spike protein, il cui mRNA è da loro designato mRNA-1273) e protocollo clinico (studio in doppio cieco, endopoints, numero di dosi, ...) sovrapponibili allo studio di Pfizer .
In sintesi:
- I partecipanti allo studio di Moderna sono stati divisi in due gruppi, 15 mila ciascuno, uno trattato con il placebo e l'altro con il vaccino, due dosi a 28 giorni di distanza. Il monitoraggio della comparsa dei sintomatici è iniziato dopo la somministrazione della seconda dose.
- Nel gruppo placebo 185 hanno sviluppato Covid-19 (30 di questi nella forma grave e 1 decesso) una volta tornate nella loro vita quotidiana (ovvero, esposti al virus come ogni individuo della popolazione di appartenenza).
- Il gruppo vaccinato ha visto invece 11 casi, nessuno dei quali nella forma grave.
- Quindi il 94,1% dei contagiati aveva ricevuto il placebo.
- Nessuno dei partecipanti ha riportato effetti collaterali gravi (ricordo che grave negli studi clinici si riferisce a "necessità di essere ricoverato"). Una piccola percentuale di coloro che hanno ricevuto il vaccino ha manifestato sintomi come dolori muscolari e mal di testa.
Da Moderna si fa sapere che inizierà la procedura per ottenere l'approvazione entro la fine del mese quando saranno disponibili tutti i dati relativi alla sicurezza del trattamento.
Dato non secondario, Moderna ha ottenuto fonti federali per 955 milioni di dollari di impegni all'acquisto da parte della Biomedical Advanced Research and Development Authority (BARDA).
Un finanziamento che i contribuenti americani, diversi da quelli europei abituati a vedere i soldi statali scomparire sotto voci di bilancio tra le più fantasiose, tengono sotto attento monitoraggio e per il quale si aspettano un "dividendo" (vaccino pronto all'uso) o in subordine la totale restituzione dei fondi allocati.
I dati finali del COVE study di Moderna sono stati pubblicati il 30/11 e nello stesso giorno è iniziata la procedura per ottenere l'autorizzazione all'uso del vaccino dalla FDA secondo le regole del "Emergency Use Authorization"
Fonti
- An mRNA Vaccine against SARS-CoV-2 — Preliminary Report
** Moderna vs Pfizer/BioNTech**
Passiamo ora alla vera differenza tra i due vaccini, cioè un parametro chiave come la stabilità e temperatura di stoccaggio, parametri importanti dato che i loro vaccini riscaldati, rimangono utilizzabili solo per pochi giorni.
Entrambi i vaccini usano come veicolo nanoparticelle lipidiche, sviluppate dalle aziende negli anni scorsi per fini terapeutici diversi, da cui derivano le differenze nelle proprietà.
Quando le terapie a base di mRNA sono apparse per la prima volta sulla scena nel 2010, c'è stato un enorme sforzo per migliorare i sistemi di rilascio delle nanoparticelle esistenti. Ogni azienda che usa RNA ha la propria piattaforma LNP e ognuna è adattata alle esigenze e agli obiettivi dell'azienda. Onpattro di Alnylam ha prodotto il primo sistema di delivery siRNA-LNP approvato dalla FDA.
In sintesi:
- Il vaccino di Moderna permette una conservazione a lungo termine a -20 °C ed è stabile per 30 giorni tra 2-8 °C.
- Il vaccino di Pfizer/BioNTech necessita -70 °C. Pfizer ha affermato in
merito di avere già la soluzione grazie allo sviluppo di contenitori
termici progettati appositamente, basati sul ghiaccio secco, in grado di
mantenere le condizioni di temperatura raccomandate per un massimo di
10 giorni. Ciascun contenitore è in grado di trasportare fino a 5 mila
dosi.
-20
°C vs -70 °C non è un dettaglio. Fa un'enorme differenza quando devi
occuparti della spedizione e dello stoccaggio.
In prospettiva dell'enorme sforzo logistico richiesto per la distribuzione del vaccino, la produzione su larga scala è già iniziata. L'idea è che una volta ottenuto il via libera, le dosi dovranno essere pronte "ad uscire dagli stabilimenti". Sebbene lo stoccaggio nelle strutture principali (cioè i magazzini regionali prima e i grandi ospedali poi) non presenti grosse criticità nella gestione della temperatura, ogni successivo passaggio nella fase distributiva (dai magazzini alle strutture periferiche) è un fattore di rischio aggiunto: il maltempo può ritardare i voli; i congelatori sui camion refrigerati possono guastarsi; i camion possono trovarsi bloccati in ingorghi imprevisti; i contenitori possono non essere perfetti; anche solo aprire ripetutamente i congelatori per spostare i prodotti in arrivo e in uscita può danneggiare i vaccini.
Ulteriore complicazione è che entrambi i vaccini richiedono due dosi, distanziate di alcune settimane tra loro. Tradotto, vuol dire raddoppiare la capacità gestionale.
Ogni violazione del controllo della temperatura degrada il vaccino e ogni volta che il vaccino si sposta, le possibilità che ciò accada aumentano, quindi i funzionari sanitari devono pianificare il tutto in modo preventivo e tenere traccia di ogni anomalia.
Prevenire i problemi attraverso analisi dei punti critici non è un optional ma un obbligo che ogni responsabile della logistica deve pianificare in anticipo. Il "non era prevedibile" è difficilmente accettato come scusa sia dalle autorità di vigilanza che dal tuo stesso board.
Allora perché Moderna ha un'opzione -20 °C rispetto a BioNTech? Il motivo è nel loro background farmaceutico.
Vediamo le ragioni "industriali" di queste differenze.
BioNTech ha come core business lo sviluppo di farmaci antitumorali personalizzati e
immunoterapie. Nel loro
portfolio terapeutico, oltra al mRNA, hanno una serie di
altre modalità terapeutiche come la
CAR-T e gli anticorpi. Il paziente "tipo" delle loro terapie era numericamente basso (terapia "su misura") e ospedalizzato in centri specializzati dove la conservazione dei prodotti a -70 °C non è mai un problema; non c'era ragione di investire risorse per perseguire
l'opzione -20 °C.
Per questa ragione quando hanno deciso di usare il loro know-how per sviluppare il vaccino a RNA anti-covid19 hanno sfruttato la tecnologia LNP già testata in precedenza (non c'era il tempo per ottimizzare un nuovo veicolo).
Moderna al contrario aveva focalizzato le sue strategie sull'utilizzo del mRNA come strumento terapeutico multimodale. Dato il focus di sviluppare
vaccini profilattici, sapeva di avere bisogno di prodotti stabili e che non necessitassero di temperature di conservazione inferiori a quelle facilmente implementabili nella routine quotidiana. In conseguenza parte dei suoi sforzi si indirizzarono da subito nello sviluppo di LNP capaci di stabilizzare (e non solo trasportare) l'acido nucleico. Uno dei fattori chiave fu lo sviluppo di lipidi ionizzabili, in grado di
acquisire una carica positiva così da interagire con l'acido nucleico
caricato negativamente, inglobati entro particelle lipidiche superficiali a carica neutra adatti per la "consegna". Una scelta che ha imposto lo sviluppo di simulatori di dinamica molecolare con cui progettare il miglior mix, prima ancora di sintetizzarli e testarli. Quando è sorta l'urgenza covid19, Moderna iniziò il processo di sviluppo sfruttando il proprio know-how sul "veicolo".
Quindi punti di partenza molto diversi quelli di Pfizer e Moderna.
È oramai un decennio che Moderna Therapeutics (sotto la guida di Stephane Bancel, il CEO) lavora sulla tecnologia mRNA con il fine di riuscire a rendere le cellule stesse
dell'organismo da curare, le produttrici del farmaco. Affinché
l'approccio funzioni, il carrier deve trasportare in modo sicuro
l'mRNA alle cellule del corpo senza che il carico utile si liberi
inutilmente nel flusso sanguigno.
A giugno, i ricercatori del NIH e di Moderna hanno depositato sulla piattaforma bioRxiv un manoscritto con i dati preclinici ottenuti dai test con mRNA-1273. Nel preprint
viene descritto il vaccino anti-covid19 in cui si sfrutta come veicolo
la tecnologia nanosomica di proprietà del brevetto Arbutus (ma secondo
Moderna il claim del brevetto non copre questo particolare utilizzo e in ogni caso loro "sono andati oltre").
Ovviamente quanto scritto nell'articolo e quanto poi usato nello studio
clinico potrebbero riguardare veicoli diversi. In verità il precedente non è l'unico articolo da loro pubblicato sul tema. Già nel 2019 si trova uno studio simile (pubblicato sulla prestigiosa rivista NEJM) finalizzato al trattamento della SARS, il cui virus è strettamente imparentato con l'attuale responsabile del covid19. Già allora si parlava di un veicolo di tipo LNP.
Quale dei due è il migliore? Difficile leggere nella sfera di cristallo, ma un aiuto viene dal confronto tra i due titoli azionari il cui trend rivela il giudizio degli analisti (edit: guarda caso alcuni giorni dopo le agenzie hanno rilanciato la notizia che dopo gli USA anche la UE ha prenotato da Moderna un centinaio di milioni di dosi)
 |
Moderna (mRNA) vs Pfizer (PFE). Ricordo che il valore "in questo momento"(01/12/2020) non rispecchia o predice il trend futuro. Per cui è sempre sconsigliato "seguire il gregge" comprando azioni sulle performance passate. Per avere le quotazioni aggiornate vi rimando alla pagina su finance.yahoo
|
***
Domanda ovvia: perché dovremmo preoccuparci del vaccino AstraZeneca quando abbiamo già altri due candidati vaccini che si sono comportati molto bene?
La realtà è che avremo bisogno che diversi produttori di vaccini producano il loro vaccino alla massima capacità per soddisfare la domanda mondiale ed evitare di mettere tutte "le uova in unico paniere" con il rischio che il fallimento di un approccio (ad esempio nella protezione mid-term) abbia un effetto a valanga.
Il vero punto di forza del vaccino di AstraZeneca è nella sua temperatura di conservazione, ideale per il trasporto.
La notizia buona è che tutti e 3 gli approcci centrati sull'usare come bersaglio la proteina S (Pfizer, Moderna e AstraZeneca) hanno dato valori di efficacia superiori o uguali al 90%, almeno a breve termine.
***VACCINO MIX, a dosi alternate***
Studio clinico combinato usando 8 combinazioni di vaccini
Lo studio è ufficialmente iniziato il 2 febbbraio.
Almeno nella prima fase è organizzato in 8 diversi bracci per testare 8 diverse combinazioni.
Queste le combinazioni programmate, per ora:
- 2 dosi del vaccino Oxford / AstraZeneca a 28 giorni di distanza
- 2 dosi del vaccino Oxford / AstraZeneca a 12 settimane di distanza - come gruppo di controllo
- 2 dosi del vaccino Pfizer / BioNTech a 28 giorni di distanza
- 2 dosi del vaccino Pfizer / BioNTech a 12 settimane di distanza - come gruppo di controllo
- il vaccino Oxford / AstraZeneca per la prima dose, seguito dal vaccino Pfizer / BioNTech per la seconda, a 28 giorni di distanza
- il vaccino Oxford / AstraZeneca per la prima dose, seguito dal vaccino Pfizer / BioNTech per la seconda, a 12 settimane di distanza
- il vaccino Pfizer / BioNTech per la prima dose, seguito dal vaccino Oxford / AstraZeneca per la seconda, a 28 giorni di distanza
- il vaccino Pfizer / BioNTech per la prima dose, seguito dal vaccino Oxford / AstraZeneca per la seconda, a 12 settimane di distanza
Maggio 2021. Su
The Lancet sono stati pubblicati i risultati di uno studio condotto su un migliaio di soggetti divisi in due gruppi vaccinati con con Pfizer prima e AstraZeneca poi (e viceversa) hanno mostrato un incremento di effetti collaterali (nessuno tale da richiedere ospedalizzazione). Non ci sono informazioni sul grado di protezione fornita
***AGGIORNAMENTI***
Per avere gli aggiornamenti sullo stato vaccinazioni in Italia vi rimando al sito dedicato su
lab24.ilsole24ore |
| Tabella riassuntiva dei vaccini approvati nei diversi paesi insieme a dosi previste e condizioni di conservazione (credit: Wellcome Trust, BBC research) |
22/12/20
31/01/21
I vaccini in studio sono stati pensati per essere forniti in due dosi a distanza di circa 3 settimane. Data la penuria dei vaccini (a fronte della domanda) la BBC ha verificato l'efficacia di ciascun vaccino principale dopo una singola dose.
Moderna: 80.2%
Johnson & Johnson:
66% (malattia moderata) e
85% (forme gravi) dopo 28 giorni. I numeri tuttavia variano a seconda del continente ad indicare diversa efficacia con diverse varianti. Riferendoci alla protezione da forme moderate di Covid i numeri sono 72% (USA), 66% (Sudamerica) e 57% (Sudafrica). Nessuna differenza regionale invece per la forma severa.
CoronaVac: 65.3% o 91.25% a seconda che i dati vengano da Indonesia o Turchia (!?)
Oxf-AZ: 64.1%
Pfizer/BioNtech: 52%
4/02/21
Iniziato in UK il primo trial clinico che esamina l'efficacia di una
vaccinazione "mix" basata su 8 diverse combinazioni di vaccino. Vedi nota a fondo pagina. Lo studio è importante per massimizzare la copertura vaccinale in caso di scorte non sufficiente a rispettare le tempistiche tra la prima e seconda dose di vaccino.
Necessità rafforzata dalle differenze nel disegno degli studi clinici di ciascun vaccino. Infatti non solo la dose di vaccino è diversa tra Moderna (100 µg) e Pfizer (30 µg) ma anche gli intervalli di tempo tra le due dosi e perfino le milestones sono diverse; Pfizer conta i casi sintomatici a partire da 7 giorni dopo la seconda dose, Moderna ne aspetta 14. Al contrario J&J ha anche valutato la capacità di protezione da Covid19 nelle forme da media a severa, dopo una singola dose utilizzando non solo i sintomi ma anche test di laboratorio per contabilizzare i positivi a partire da 14 o 28 giorni dopo la prima dose.
Arrivare dopo ha permesso a J&J di ottenere dati di efficacia contro le nuove varianti più contagiose (assenti durante lo studio Pfizer e Moderna) il che oggi rappresenta un valore aggiunto.
Il vero punto di forza del vaccino J&J è che sembra funzionare contro la variante sudafricana.
Mancano in toto i dati sulla protezione del vaccino per le forme asintomatiche dell'infezione.
Tutti i vaccini testati hanno un rischio intrinseco di reazioni allergiche.
12/02/21
14/02/21
6/03/21
7/03/21
Schema riassuntivo dello sviluppo dei vaccini anti-covid19 (fonte
Bloomberg)
11/03/21
Dopo avere reso pubblici
i risultati degli studi clinici, Novavax ha iniziato l'iter per l'autorizzazione all'uso del vaccino. Come indicato nei dati preliminari il braccio dello studio clinico condotto in Sud Africa mostra una netta riduzione di efficienza rispetto al braccio in UK (54 vs 89%) ad indicare l'esistenza nell'area di una variante virale più "resistente" al vaccino. Il dato confortante è che tra i vaccinati che hanno sviluppato la malattia non si registrano forme gravi
17/03/21
Mentre nel resto del mondo industrializzato l'effetto dei vaccini si vede con un calo del numero di nuovi casi (Israele, Emirati Arabi Uniti, UK e anche USA) in Europa si vede l'opposto. Un articolo del NYT riassume bene il tutto con "
Europe's vaccine mess".
31/03/21
1/04/2021
I risultati di efficacia del vaccino
Pfizer nel periodo 2-6 mesi si assestano a circa il 90%, solo di poco inferiore rispetto alla protezione iniziale. L'immunità post-infezione (vera) dopo almeno 7 mesi oscilla tra il 71 e 83%.

20/04/21
06/05/21
Sputnik. Dopo la pubblicazione su Lancet di un articolo tutto sommato positivo sul vaccino russo (non approvato in Europa e USA ma diffuso in vari paesi), l
a rivista BMJ attacca le conclusioni definendo l'analisi superficiale.
14/05/21
In aggiunta ai dati di marzo sul vaccino di AZ, arriva ora uno
studio dell'università di Birmingham in cui si evidenzia il miglioramento della protezione vaccinale sugli over-80 se si posticipa la seconda dose a 12 settimane invece delle 3 previste.
24/05/21
Infografica aggiornata dell'efficacia dei vari vaccini rispetto alle varianti
03/06/21
Interessante l'idea di uno
spray nasale basato su IgM capace (in topo) di neutralizzare più di 20 varianti del virus fino ai polmoni. Potrebbe essere utile come misura di protezione ulteriore per chi è stato esposto al virus o per coloro per cui la vaccinazione non è efficace.
18/06/21
08/21
Uno dei "difetti" intrinseci dei vaccini iniettati è la scarsa capacità di indurre la produzione di sIgA che rappresentano la difesa e barriera principale nella mucosa, fondamentale per impedire l'ingresso del patogeno. Ecco la ragione per cui le persone vaccinate possono lo stesso essere infettate anche se in modo asintomatico e in questo modo continuare a rilasciare virus dalle secrezioni nasali. Ad oggi i vaccini anti-covid sono fondamentali per minimizzare il rischio di infezioni serie (da ospedalizzazione) il che non è poco.
Si sta lavorando allo sviluppo di vaccini da mucosa (ad es. spray nasali) alcuni dei quali hanno dato buoni risultati in topi.
Articoli tematici:
09/21
Sebbene Pfizer e Moderna sia spesso definiti come equivalenti alcuni studi evidenziano differenza di efficacia nei mesi successivi alla seconda dose.
L'ultimo studio di questo tipo,
pubblicato sul New England Journal of Medicine, ha valutato l'efficacia nel mondo reale dei vaccini nel prevenire le malattie sintomatiche in circa 5 mila operatori sanitari in USA. Lo studio ha rilevato che il vaccino Pfizer-BioNTech aveva un'efficacia del 88,8% rispetto al 96,3% di Moderna.
Se il divario di efficacia continua ad ampliarsi, potrebbe avere implicazioni per il dibattito sui cosa usare per il richiamo.
10/21
Non inatteso il
commento di Anthony Fauci (FDA) riguardo al vaccino J&J. I dati indicano che il doppio dosaggio sarebbe stato da preferire rispetto a quello singolo. In effetti le uniche persone che conosco che si sono infettate nonostante la vaccinazione sono quelle che avevano ricevuto il vaccino J&J in singola dose.
11/21
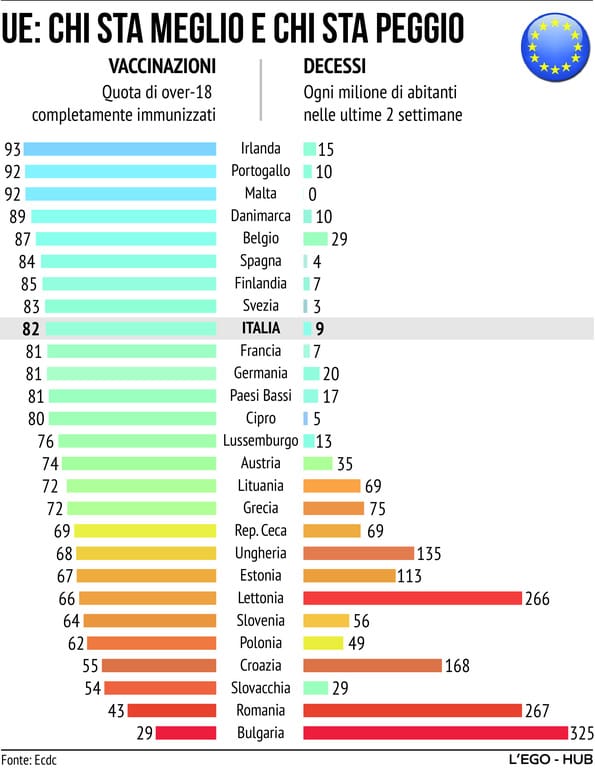
Un semplice grafico riferito ai decessi delle ultime due settimane nei diversi paesi UE mostra chiaramente la relazione inversa tra copertura vaccinale e rischio.
















Nessun commento:
Posta un commento