Aggiorno il precedente articolo (in calce) per segnalare uno studio preliminare fatto su modelli animali per il tumore del polmone non a piccole cellule, usando batteri ingegnerizzati.
Lo studio è stato pubblicato da un team della Columbia University sulla rivista Scientific Reports a dicembre 2022.
In estrema sintesi, lo studio esplora come sviluppare terapie batteriche in sinergia con altri trattamenti per migliorarne l'efficacia senza aggiungere ulteriore tossicità.
Punto di partenza il sequenziamento del pool di RNA (trascrittoma) di cellule di tumore polmonare esposte a particolari ceppi di batteri; dall'analisi delle variazioni di espressione genica che queste cellule sviluppavano per resistere ai batteri, si sono identificate le vie metaboliche attivate solo nelle cellule tumorali e non quelle normali, su cui indirizzare appositi farmaci. I ricercatori hanno potuto così osservare che una volta bloccate queste vie, il trattamento delle tossine batteriche insieme al farmaco (ad esempio un inibitore della AKT) mostrava un netto incremento di efficacia.
Fonte
- Design of combination therapy for engineered bacterial therapeutics in non-small cell lung cancer.
Dhruba Deb et al, (2022) Scientific Reports, 12:21551
*** Batteri modificati per distruggere un tumore (aprile 2020) ***
A metà XIX secolo scienziati come Wilhelm Busch, Friedrich Fehleisen e Paul von Bruns riportarono un dato empirico assolutamente inatteso: la regressione spontanea del tumore nei pazienti in cui era comparsa una infezione batterica da streptococco nel tessuto operato.
La conferma sperimentale di questi dati fu ottenuta pochi anni dopo da William Bradley Coley, chirurgo americano e pioniere dell'immunoterapia antitumorale, che dimostrò l'effetto terapeutico inoculando in pazienti con tumori inoperabili due specie di Streptococcus (miscela nota come "tossine di Coley").
Passano alcuni anni e nel 1943 Murray Shear identifica l'agente causale del "rigetto tumorale" nella endotossina lipopolisaccaridica (LPS). Bisognerà aspettare il 1975 perché Lloyd Old scopra il TNFa (Tumor Necrosi Factor alpha) e la linfotossina (prodotte da macrofagi e linfociti, rispettivamente), come le proteine responsabili della uccisione delle cellule tumorali.
Il misterioso effetto terapeutico può essere compreso se si pensa ad un "effetto collaterale" dell'infezione. In sintesi, la presenza dei batteri in prossimità del tumore causa il reclutamento locale del sistema immunitario che "scopre" la presenza di cellule aberranti attaccandole.
Nota. Ricordate che i tumori insorgono nei nostri tessuti fin dalla nascita ma nel 99,9% dei casi le cellule anomale vengono scoperte e rimosse dal sistema di sorveglianza. Capita che queste cellule anormali riescano a mimetizzarsi tra le cellule normali e / o divengano capaci di "spegnere" le cellule di pattuglia non appena queste le riconoscono. Questo è il primo passo che consente il loro sviluppo e l'acquisizione di caratteristiche sempre più invasive fino al tumore conclamato e alla metastasi.
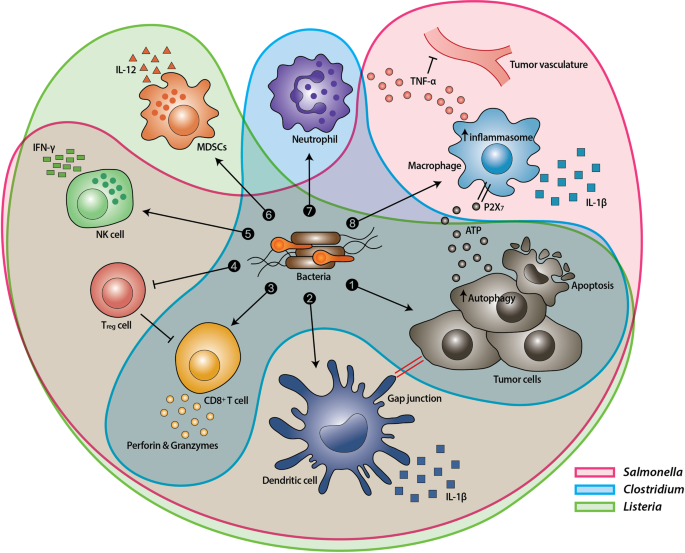 |
| La presenza di batteri in un tumore induce una reazione immunitaria "forzando"uno stato infiammatorio anche dove prima c'era un tumore invisibile (image credit to: Jung-Joon Min et al, (2019) EMM) |
Nonostante le premesse l'approccio terapeutico non assurse mai a terapia clinica dopo gli anni '60 a causa della scarsa affidabilità del metodo, intesa sia come effetti collaterali (rischio shock anafilattico o sepsi) che di una efficacia ben inferiore (e nemmeno utilizzabile su tutti i tumori) rispetto alla chemioterapia o alla radioterapia.
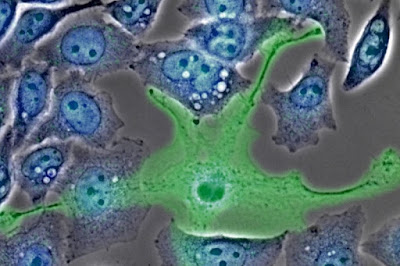 |
| Un macrofago (in verde) mentre passa tra le cellule tumorali. Molto spesso i macrofagi vengono "silenziati" dalla cellule tumorali con segnali che a lui risuonano come "siamo cellule normali, puoi proseguire". Quando questo avviene non solo il macrofago non attacca e "dissuade" anche i linfociti dall'iniziare l'attacco, ma fornisce alle cellule tumorali anche fattori di crescita. I batteri potrebbero sabotare questa connivenza attivando lo stato infiammatorio (image credit: Memorial Sloan Kettering Cancer Center) |
Ma l'idea di riuscire ad ottimizzare l'approccio in modo da renderlo sicuro, controllabile ed efficace è sempre rimasto nella mente dei ricercatori.
Ora, molti decenni dopo, siamo forse giunti ad un punto di svolta con la pubblicazione di uno studio sulla prestigiosa rivista Nature Medicine, il cui contenuto può essere riassunto con
"batteri programmati per colpire le cellule cancerose".
Punto fondante del lavoro, il dato consolidato che molti tumori sovraesprimono la proteina di superficie CD47, una proteina con funzione anti-fagocitaria che nei tessuti normali serve come "mantello di invisibilità" (se la possiedi, il macrofago non ti degna di uno sguardo). Nel caso dei tumori la sua funzione è una delle alterazioni che permettono di sfuggire al controllo mostrando ai macrofagi il messaggio "non mangiarmi: sono normale". (sic! Il termine inglese è proprio "do not eat me".
L'alta espressione del recettore CD47 è stata sfruttata per la diagnostica e per lo sviluppo di terapie equiparandola ad una "bandierina" che segnala "questa è una cellula tumorale ed è un bersaglio".
Passaggio preliminare la duplice modifica genetica del batterio Escherichia coli:
L'alta espressione del recettore CD47 è stata sfruttata per la diagnostica e per lo sviluppo di terapie equiparandola ad una "bandierina" che segnala "questa è una cellula tumorale ed è un bersaglio".
Facile in ambito diagnostico. L'analisi istochimica distingue chiaramente il forte segnale di CD47 sulle cellule tumorali rispetto a quello debole delle cellule normali.I ricercatori della Columbia University guidati da S. Chowdhury, hanno cercato un'altra strada, usando l'alta espressione tumorale di CD47 come un "faro" per guidare in loco un "missile terapeutico" basato sui batteri. Il sistema è stato messo a punto su modelli murini.
La situazione si complica quando si vuole sviluppare un'arma che utilizzi CD47 come guida. Facciamo un esempio semplice e immaginiamo una molecola capace di riconoscere ed occultare CD47, così da rimuovere il lasciapassare immunitario e favorire l'attacco dei macrofagi. L'utilizzo sistemico di tale molecola andrebbe a colpire anche le cellule normali, causando effetti collaterali tra cui anemia e trombocitopenia.
Passaggio preliminare la duplice modifica genetica del batterio Escherichia coli:
- reso capace di attivare una procedura di autolisi in modo sincrono con i suoi simili una volta raggiunta una certa densità;
- trasformato in un "container", il cui carico sono molecole capaci di bloccare CD47.
I batteri riescono a raggiungere la densità voluta nel tumore essendo questa un'area immuno-privilegiata, cioè a bassa densità di azione immunitaria a causa delle contromisure che il tumore attiva durante la sua evoluzione. La lisi in sincrono locale evita il rilascio delle molecole effettrici nei tessuti sani, minimizzando così il rischio di effetti collaterali. La sincronizzazione è basata sul sistema di comunicazione batterico del quorum sensing.In sintesi, due sono i meccanismi immunitari che tale trattamento vuole stimolare:
- la presenza di batteri vivi innesca una infiammazione locale nel tumore che richiama le cellule immunitarie;
- i macrofagi si "accorgono" della presenza di cellule anomale (CD47 bloccato) e iniziano a fagocitarle, rilasciando nel contempo citochine che richiamano i linfociti T infiltranti. Una volta attivati, i linfociti continueranno l'opera di bonifica anti-tumorale in altri tessuti rimuovendo metastasi altrimenti invisibili.
Il risultato in topi è stato più che positivo:
- regressione tumorale;
- assenza di metastasi
- netto aumento del tempo di sopravvivenza.
Chiaramente si tratta di un primo studio di fattibilità (proof of concept) a cui dovranno seguire nuovi test di sicurezza e di efficacia con altri modelli tumorali in roditori.
Solo alla fine di questo percorso si potrà cominciare a pensare a studi clinici sull'essere umano.
Fonte
- Programmable bacteria induce durable tumor regression and systemic antitumor immunity.
Chowdhury, S. et al. (2019) Nat. Med. 25, 1057-1063
***
Un tema in parte correlato è quello dell'utilizzo di virus per infettare e distruggere le cellule tumorali in modo diretto (virus litici e/o ingegnerizzati per esprimere una tossina) o indiretto (attivazione risposta immunitaria locale). Vedi sul tema la review di K. Harrington et al (Nat. Rev. Drug Discovery - 2019)
Altro esempio di virus "benefici" è quello dei batteriofagi (i virus dei batteri) che hanno avuta una recente rinascita come trattamento dei batteri multiresistenti agli antibiotici; dato che i fagi coevolvono insieme ai batteri, possono agire come "antibiotici" in grado di autoadattarsi alla comparsa di ceppi resistenti alla infezione (articolo precedente sul tema --> qui).


Nessun commento:
Posta un commento