Ringiovanire o anche solo rallentare l'inesorabile scorrere delle lancette è un sogno inseguito dagli umani fin dal momento in si accese la scintilla dell'IO e con essa l'inevitabile consapevolezza della propria caducità.
Sebbene io appartenga più alla scuola di pensiero riassunta dalla canzone "Who Wants to Live Forever?" dei Queen (colonna sonora del mitico film "Highlander"), è indubbio che i continui progressi nella ricerca medica abbiano rinforzato in molti il "miraggio della giovinezza".
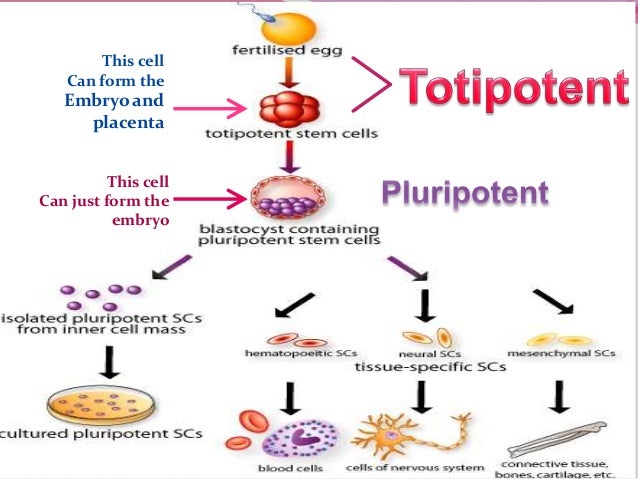
Non è semplice definire in poche parole la biologia dell'invecchiamento essendo un fenomeno che si manifesta su più livelli. Se guardiamo ad una cellula dobbiamo confrontarci con un valore, il Limite di Hayflick, che definisce il massimo numero di divisioni a cui una cellula può andare incontro; un valore che nell'essere umano è compreso tra 50 e 70. La capacità replicativa della cellula è soggetta a molteplici controlli e molti sono gli attori in gioco, uno di questi è la telomerasi. Si tratta di un enzima essenziale per "rattoppare" le estremità dei cromosomi - dette telomeri - che per motivi intrinseci al processo replicativo si accorciano ad ogni duplicazione del DNA. Dopo un certo numero di mitosi, il gene codificante la telomerasi comincia a spegnersi, causando così la progressiva riduzione delle estremità cromosomiche non più riparate; quando la lunghezza dei telomeri scende sotto un certo valore la cellula "sente il danno" e attiva il blocco proliferativo. Il processo nel suo complesso è noto come senescenza cellulare. Molte cellule tumorali sfuggono a questo controllo mantenendo attiva la telomerasi, eliminando così uno dei meccanismi di controllo, oltre quello dell'apoptosi (alias "suicidio cellulare programmato"). La senescenza cellulare serve sostanzialmente ad evitare che le cellule "vecchie" (quindi più danneggiate) generino altre cellule in una spirale ascendente di danni genetici. La correlazione tra età e danno cellulare è ben evidente se si osserva l'aumentata frequenza dei tumori nella popolazione con l'aumento della età media. Nelle cellule germinali e in genere nelle cellule staminali, il limite di divisioni cellulari possibili viene superato sia agendo sullo stato epigenetico che attuando una divisione cellulare "asimmetrica" in cui solo una delle cellule figlie mantiene tutta o in parte la staminalità mentre l'altra è "libera" di iniziare il percorso differenziativo.
Se ci focalizziamo invece sull'organismo, l'invecchiamento è il risultato dei danni accumulatisi nelle cellule (tra l'altro divenute metabolicamente inefficienti) e nella conseguente ridotta capacità dei tessuti di ripararsi; con l'età la cute diventa meno elastica, le giunture meno flessibili, le ossa più fragili e siamo in media meno capaci di difenderci sia dai patogeni che dalle nostre stesse cellule "alterate". Ogni ipotetica terapia finalizzata a contrastare l'invecchiamento non potrà quindi prescindere dalla necessità di minimizzare i danni cellulari (impossibile sul lungo periodo dato che una cellula produce le tossine che la danneggeranno) o di sostituire i "pezzi" danneggiati.
Bisogna infine sottolineare che l'invecchiamento non è un fenomeno universale sebbene sia particolarmente evidente nei mammiferi e anche nei lieviti (--> "Non tutti gli organismi invecchiano"). Vedi anche --> QUI.
Molte sono state le vie percorse (nella realtà o nella finzione narrativa) per inseguire il miraggio della vita "eterna" e per contrastare il naturale decadimento fisiologico. Dal mero assemblaggio di pezzi di ricambio "rigenerati" (--> "Frankestein" di Mary Shelley) oppure "freschi" (--> "Non lasciarmi" di Kazuo Ishiguro), alle vere pratiche efferate attuate dalla contessa Erzsébet Báthory (quasi conterranea e contemporanea di Vlad) che usava il sangue delle vergini come balsamo ringiovanente, arriviamo all'immaginario cyberpunk di "Ghost in the Shell" con il suo armamentario di protesi e "editing" genetico (non così "irrealistico" oggi rispetto ai tempi in cui il fumetto uscì). Nel mezzo ci sono tutti gli elisir miracolosi o i nutrienti salutistici di utilità dubbia (ancorché una dieta sana sia importante ma non determinante se abbiamo un background genetico "ottimo" o "cattivo").
Nella realtà odierna, qualsiasi laboratorio di biologia e genetica molecolare "di medio livello" è dotato di tutti gli strumenti per riprogrammare le cellule in coltura, spingendone indietro la lancetta del loro orologio biologico.
Detto così potrebbe sembrare una sorta di Frankesteinizzazione in vitro ma in verità si tratta di metodi sviluppati nell'ultimo decennio per risolvere il problema etico dell'utilizzo di cellule embrionali umane.
Nota. Il problema etico, e le relative limitazioni legali, è un fatto puramente occidentale. In oriente la flessibilità operativa è molto maggiore come ben evidenziato dagli studi sulla clonazione umana in Corea (parlo solo di quelli dichiarati; non dubito che studi simili siano in atto in Cina). Per approfondimenti --> "Il turismo delle staminali".
L'idea di usare le cellule embrionali (e in particolare quelle nelle primissime fasi dopo la formazione dello zigote) è legata alla loro totipotenza, la capacità di originare un nuovo organismo completo, e quindi a qualunque cellula del corpo. Tutte le altre cellule (non solo nell'adulto ma anche quelle dei feti ad uno stadio di sviluppo appena più avanzato) hanno perso tale potenzialità, limitandosi nel migliore dei casi alla pluripotenza; ad esempio le cellule staminali emopoietiche possono originare i vari tipi di cellule del sangue ma sicuramente non un epatocita. Le staminali prelevate dal cordone ombelicale sono utilizzabili "per sé" (leggasi senza manipolazioni genetiche) come sostituti emopoietici ma non come strumento per riparare altri tessuti.
Quando si iniziò ad indagare la possibilità di usare le cellule per riparare i tessuti danneggiati, la scelta più ovvia cadde sulle cellule embrionali mancando all'epoca ogni conoscenza su come "convincere" altri tipi di cellule a fare quel lavoro. Negli ultimi anni questa necessità è stata quasi del tutto aggirata grazie agli studi di Shinya Yamanaka e John Gurdon sulla riprogrammazione delle cellule adulte (lavoro che è valso loro il Nobel nel 2012). Per dirla in modo semplice si è scoperto come trattare le cellule differenziate dell'adulto (non tutte per il momento) in modo da far loro "perdere la memoria di cosa erano", rendendole capaci di trasformarsi in un altro tipo di cellula; uno strumento estremamente potente quando il fine è utilizzare le cellule dello stesso soggetto minimizzando così il rischio di rigetto (ad esempio le cellule della cute del braccio per riparare il tessuto cardiaco). Il trattamento si basa sul forzare l'espressione di alcuni geni o mediante l'inserimento degli stessi dall'esterno oppure con trattamenti chimici in grado di "risvegliarli" dal loro torpore "adulto". Quattro sono i geni chiave - Oct4, Sox2, Klf4 e c-Myc - e codificano per proteine regolatorie in grado di di indurre una serie di effetti a cascata.
Il trattamento è sufficiente per "cancellare" il programma che le cellule avevano seguito durante lo sviluppo embrionale e che le aveva "intrappolate" dentro una finestra di possibilità differenziative ristretta, pronte così per seguire un nuovo percorso.
La gerontologia sperimentale si basa sulle conoscenze acquisite nel campo dell'invecchiamento cellulare sull'uomo e sui modelli animali per sviluppare trattamenti in grado di agire sull'orologio biologico o più prosaicamente per contrastare i danni legati all'età.
Il campo è molto interessante ma altrettanto specialistico; riassumerò di seguito alcuni lavori cercando di condensarli in poche righe.
- Un primo filone di ricerche parte da un approccio classico (i primi esperimenti risalgono all'inizio del '900) centrato su sulla ricerca di fattori solubili presenti nel sangue in grado di "ringiovanire" i tessuti. Si tratta per dirla in modo più tecnico di esperimenti di parabiosi eterocronica o semplicemente dell'unione chirurgica dei vasi di due animali di età diversa dimostratasi capace di ringiovanire i tessuti dell'animale più anziano. Più recentemente e con modalità nettamente meno invasive si è ottenuto lo stesso effetto dopo iniezioni di plasma prelevato da animali giovani. Elemento comune è evidentemente la presenza nel plasma di un qualche fattore capace di riprogrammare le cellule anziane e/o di riattivare le staminali dormienti. Vedi anche il precedente articolo -->"Il sangue giovane ringiovanisce il cervello vecchio".
- Il vero punto di svolta lo si ebbe però nel 2006 con gli studi sulla riprogrammazione delle cellule adulte differenziate riportandole ad uno stato pluripotente. L'idea portante era di ricreare qualcosa di simile allo stato germinale, trasferendo il nucleo delle cellule trattate all'interno di uno zigote a cui era stato rimosso il nucleo (nel cui citoplasma rimanevano però le istruzioni "di inizio") ponendo così le basi per la clonazione. Una capacità ottenuta solo in parte e con risultati alterni (in Cina e Giappone è fiorente il mercato legale della clonazione del proprio animale domestico). In un ambito più "scientifico", riprogrammare le cellule dell'adulto è la via "ideale" per il trattamento di patologie degenerative (o successive a lesioni spinali) grazie alla possibilità teorica di generare sostituti dei tessuti lesionati, in primis cellule nervose e muscolari.
- Più recentemente Alejandro Ocampo e collaboratori hanno descritto in un articolo su Cell che era possibile aumentare la vita media di topi affetti da sindrome di invecchiamento precoce facendo loro esprimere i fattori di riprogrammazione prima citati; la scelta di usare i topi progerici è una "scorciatoia" sperimentale che permette di ottenere più velocemente i dati sulla efficienza di una terapia anti-invecchiamento. Non solo la vita media dei topi aumentava del 20%, ricalcando l'effetto ottenibile con i metodi classici della restrizione calorica nella dieta, ma gli effetti del ringiovanimento erano osservabili sia a livello cellulare che tissutale. La ripetizione dell'esperimento su topi normali ha dato però solo una parziale conferma; i tessuti mostravano sì un netto miglioramento delle capacità funzionali (come la riparazione delle lesioni) nei topi anziani, ma non si sono avute evidenze statisticamente significative di un effetto sulla longevità. Il vero punto importante viene però dall'avere ottenuto gli effetti cercati (almeno nei topi progerici) facendo esprimere i geni candidati solo per tempi limitati evitando così i danni dell'espressione continuata. Esperimenti precedenti avevano infatti dimostrato che forzare l'espressione dei geni in modo continuativo faceva perdere alle cellule lo stato differenziato e nell'animale si aveva un aumento della frequenza di tumori - teratomi nello specifico. Dato che lo scopo primo è ripristinare lo stato pre-senescente, la perdita dello stato differenziato è inutile ancorché dannosa. Esperimenti simili, ovviamente SOLO in coltura, sono stati condotti anche su cellule umane con risultati paragonabili.
L'obiettivo della ricerca futura non è - spero - quello di renderci immortali ma di sviluppare strategie per massimizzare la guarigione delle ferite, ripristinando la capacità presente naturalmente negli organismi giovani di riparare i tessuti e rimuovere efficacemente le scorie del metabolismo, causa prima dell'invecchiamento dei tessuti.
Fonte
-
et al. Cell 167, 1719–1733 (2016)
***
Nota. Qualche settimana dopo avere scritto l'articolo è stato pubblicato un lavoro sulla rivista Nature centrato sull'effetto "ringiovanente" del sangue "giovane" sul cervello. In estrema sintesi i ricercatori hanno iniettato plasma umano estratto dal cordone ombelicale, da giovani oppure da adulti in topi immunodeficienti (così da non avere problemi di rigetto). L'analisi fatta successivamente delle strutture cerebrali del topo (nello specifico il giro dentato) ha dimostrato un effetto positivo sulle funzionalità cognitive SOLO con il plasma derivato dal cordone ombelicale. I ricercatori sono andati quindi a cercare le differenze tra i diversi plasma giungendo alla conclusione che a fare la differenza in positivo è la proteina TIMP2, capace di indurre l'espressione nei neuroni del fattore di trascrizione FOS con una serie di effetti a cascata.
(Human umbilical cord plasma proteins revitalize hippocampal function in aged mice. Castellano JM et al, Nature - 2017 - 544(7651):488-492)


Nessun commento:
Posta un commento