La nuova versione di questo articolo è disponibile
e sostituisce la presente
***
Aggiunta la sezione riguardante il vaccino Moderna (seconda parte dell'articolo) e una parte introduttiva qui sotto. Per evitare eccessivi stravolgimenti del testo ho lasciato la parte descrittiva sui vaccini a RNA nella sezione del vaccino di Pfizer il cui contenuto va esteso anche al vaccino Moderna (e agli altri in fase di sviluppo)
La premessa indispensabile è che la piena approvazione e disponibilità di un vaccino Covid-19 potrebbe richiedere ancora mesi. Se tutto va bene i soggetti a rischio potrebbero riceverlo prima del nuovo anno mentre per tutti gli altri se ne parlerà a primavera.
Ottenere un vaccino attraverso studi clinici e passare dalle forche caudine di FDA o EMA è un processo complesso, costoso e che richiede tempo (vedi in proposito la serie di articoli "Nuovi farmaci e costi connessi" che ne analizza i punti chiave). Inoltre la "mera" approvazione da parte delle autorità regolatorie è solo un passaggio per fare realmente arrivare un farmaco sul mercato (alcuni non ci arriveranno mai anche se formalmente approvati). Ancora di più nel caso di un vaccino come l'attuale con un problema di logistica legato al dovere essere disponibile in tempi brevi. Il piano allo studio da mesi dal governo federale americano, noto come Operazione Warp Speed, prevede uno sforzo finanziario di 10 miliardi di dollari, mirante ad assicurare 300 milioni di dosi di vaccino entro gennaio 2021 (anche se è probabile che i tempi possano essere posticipati di 1-3 mesi) e parlo solo del mercato USA.
Vale la pena ricordare che l'avere utilizzato, in entrambi i casi, la corsia accelerata (analisi ad interim) per la valutazione dei dati clinici, ha come conseguenza intrinseca il potere valutare oggi SOLO la risposta immunitaria primaria, quella che genera la barriera anticorpale che dovrebbe minimizzare il rischio che il virus attecchisca. Questo tipo di risposta fornisce in genere una protezione temporanea che può durare anche solo due mesi (non c'è nemmeno bisogno che il virus muti perché questa risposta si attenui, spesso basta un calo dello "stimolo" virale). La maggior parte dei vaccini oggi in uso si basa invece sulla attivazione della memoria immunitaria a lungo termine, quella che permette di fare si che tu debba essere vaccinato una sola volta (eventualmente con richiamo) per darti la protezione (sempre che il virus ovviamente non muti, come nel caso del virus influenzale). Per verificare se il vaccino è stato in grado di evocare una risposta immunitaria a lungo termine sono necessari almeno 6 mesi di follow-up, quindi nella migliore delle ipotesi si avranno questi risultati in tarda primavera.
Poi c'è la questione della sicurezza da considerare. Moderna, come Pfizer, afferma che il suo vaccino è stato generalmente ben tollerato durante i test clinici. Nel caso di Moderna, gli effetti collaterali riportati dal vaccino includevano dolori muscolari, affaticamento e mal di testa subito dopo la vaccinazione. Anche in questo caso la procedura accelerata impedisce di valutare con certezza eventuali problemi sul medio periodo. Una preoccupazione, quest'ultima, in verità più formale che reale dato lo storico dei vaccini testati in questi anni (in genere se danno problemi lo danno subito); non a caso la FDA richiede solo due mesi di dati sulla sicurezza prima di rilasciare l'approvazione all'utilizzo per le situazioni di emergenza.
***
Vaccino BioNTech / Pfizer
La notizia dei giorni scorsi è che il loro vaccino anti Covid19 ha fornito una protezione del 90% tra i partecipanti allo studio clinico.
Nota. 1 settimana dopo il primo comunicato (e pochi giorni dopo che la notizia che Moderna aveva ottenuto il 94,6% con il suo vaccino) ecco arrivare i dati "definitivi" di BioNTech/Pfizer con un curioso 95% di protezione sui soggetti over-65.
Notizia che è ovviamente rimbalzata (specie sui media generalisti italiani) in modalità copia e incolla senza spesso capirne (o preoccuparsi di capire) il senso dei numeri, di loro molto importanti.xxx
Faccio qui una analisi semplificata basata sui dati disponibili. I dati completi sono accessibili oggi solo alle autorità regolatorie che dovranno decidere se la decisione della azienda di passare direttamente alla richiesta di approvazione (prima della fine di fase 3 e senza un follow up sulla mid-term protection) siano motivate.
Nota. Il procedimento è comune quando durante una analisi ad interim dei risultati di uno studio, la statistica indica un chiaro risultato in favore della efficacia del prodotto. Questa "scorciatoia" riguarda in genere farmaci progettati per malattie prive di un trattamento efficace, gravi o che colpiscono un numero elevato di persone
Il vaccino è basato su mRNA (messenger RNA), il che è già di per sé interessante. Mentre i vaccini convenzionali sono virus inattivati (un tempo si usavano versioni poco virulente del virus) o le sue proteine, nel caso di un vaccino a RNA è quest'ultima molecola che contiene le informazioni per la/e proteina/e virali.
Tra gli aspetti positivi di questo approccio, l'essere intrinsecamente meno a rischio di indurre effetti collaterali (sebbene trascurabili con i vaccini in uso oggi e sempre da ponderare con i decessi evitati grazie al suo utilizzo). Un altro vantaggio dei vaccini a mRNA è che sono più veloci da sviluppare e più facili da produrre rispetto ad altre tecnologie. Non è quindi strano che anche gli altri vaccini "in sviluppo" (cito a memoria quelli di Moderna e di CureVac) siano basati sul mRNA.
Per contro questo tipo di vaccini sono in genere sensibili alla temperatura di stoccaggio. I frammenti di DNA e RNA sono delicati e possono degradarsi rapidamente, anche a temperature refrigerate. Ecco perché congelarli alla temperatura appropriata è così importante (vedi sotto la differenza con Moderna).
Nel caso del vaccino Pfizer, l'RNA codifica per la proteina S (spike), parte del rivestimento esterno della particella virale. Perche proprio la proteina S e non, ad esempio, quella nucleocapsidica (N)? Vedi nota2 a fondo pagina.
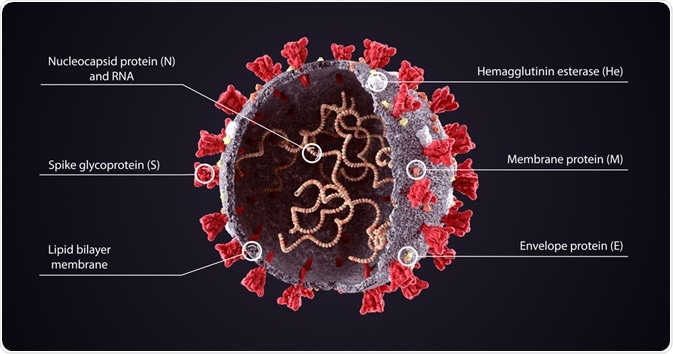 |
| Image Credit:Orpheus FX via news-medical.net |
L'mRNA è veicolato da nanoparticelle lipidiche, facilmente assorbite e scarsamente immunogeniche dopo l'iniezione. Non si vuole infatti una risposta immunitaria contro il "veicolo" ma contro l'antigene.
Ogni dose comprende 30 microgrammi del vaccino incorporato nelle nanoparticelle lipidiche (fornite da Acuitas Therapeutics e assemblate nelle strutture dedicate che Pfizer e BioNTech hanno predisposto negli Stati Uniti e in Europa). La versione di mRNA selezionata per la fase finale dello studio clinico (fase 2 e 3) è la BNT162b2, codificante per la proteina S nella forma nota come prefusion spike glycoprotein.
Una volta che il "cargo genetico" è stato consegnato alla cellula bersaglio (la nanoparticella si fonde con la membrana e rilascia il suo contenuto all'interno), la cellula decodifica la stringa di informazioni del mRNA producendo la proteina, che alla fine va a posizionarsi nella parte esterna della membrana cellulare, proprio come farebbe una cellula infettata da un virus quando si prepara ad emettere la "progenie" virale. Le cellule immunitarie nella loro incessante attività di pattugliamento, rileveranno la proteina aliena (cioè non self) che spicca dalla cellula, montando una risposta contro di essa. In assenza di dati posso ipotizzare che sia mediata da linfociti T helper e nello specifico da Th2 (risposta umorale) più che Th1 (risposta cellulare anticorpo mediata). La risposta mediata da Th2, grazie alla produzione di citochine (IL-4, IL-5, IL-6, IL-9, IL-10 e IL-13), garantisce la risposta di tipo umorale favorendo la produzione degli anticorpi. Al contrario le cellule Th1 stimolano macrofagi, NK e linfociti T CD8+ attraverso la produzione di IFN-γ e TNF-α.
Una ipotesi la mia guidata dalla nozione che se è vero che nei pazienti affetti da covid19 si ha una diminuzione dei linfociti B, delle cellule NK e della conta dei linfociti totali, sono le cellule CD4+ (rispetto alle CD8+) a subire il calo maggiore. Un calo che ha valore prognostico in quanto un basso livello di CD4+ predice sia la maggiore conta virale che una maggiore probabilità di ricovero nei reparti di terapia intensiva; i pazienti più gravi hanno livelli più elevati di cellule Th1 CD4+ rispetto ai pazienti con malattia moderata. Da questo deduco che se si vuole predisporre il sistema immunitario ad affrontare il virus in modo da non causare risposte deleterie (vedi sotto), si dovrà agire limitando la risposta mediata da Th1. Possibile in quanto l'espressione della sola proteina "aliena" nelle cellule trasfettate (che hanno catturato il nanosoma) non si associa alla emissione di segnali di pericolo (vedi danger model) con i quali la cellula segnala di essere danneggiata o infettata. Tra essi cito il recettore B7 che è fondamentale nel processo di attivazione della risposta Th1 mediata; in sintesi se il TCR su una cellula Th si imbatte in un MHC-I che porta l'antigene riconosciuto da quel TCR ma manca l'interazione tra il B7 sulla cellula APC e il CD28 sul Th, quest'ultima diviene energica, smette di partecipare alla risposta immunitaria.
L'attivazione delle cellule Th2 attiva a sua volta la proliferazione dei linfociti B che riconoscono quel particolare antigene virale e a cascata inizia la produzione di anticorpi la cui presenza serve per neutralizzare il virus, ricoprendolo, nel momento stesso in cui entra nell'organismo (nota. Processo diverso dalla opsonizzazione, che si riferisce alla eliminazione dei batteri ricoperti da anticorpi, principalmente IgG1 e IgG3, grazie al richiamo del sistema del complemento e dei macrofagi).
Nota. Il vaccino a mRNA fu pensato all'inizio come terapia contro il cancro basandosi sul principio che se si fosse "convinto" il sistema immunitario a riconoscere come "alieno" il pattern proteico tumorale (in questo caso attivando una risposta Th1) le cellule tumorali sarebbero state attaccate come estranee, quindi distrutte (ne ho accennato in un precedente articolo). Successivamente si cominciò a lavorare per applicare questo tipo di vaccinazione anche contro i virus (in primis influenza, citomegalovirus, HIV, rabbia e Zika) ma è stato l'arrivo dell'uragano Covid-19 a dare la spinta al processo grazie alle ingenti risorse, finanziare e strutturali, messe in campo.
Vediamo ora, a grandi linee, come è stato condotto lo studio clinico.
I circa 64 mila volontari sono stati divisi in 2 gruppi (gruppo di controllo a cui veniva dato un placebo e gruppo test che ricevevano il vaccino) con la procedura del doppio cieco, il che significa che né i partecipanti né i medici sapevano se il trattamento somministrato fosse il placebo o il vaccino.
Ciascun partecipante ha ricevuto due dosi di trattamento e a partire dal settimo giorno dalla seconda dose si è monitorata la comparsa di malati.
Ricordo che le persone reclutate sono state scelte in modo da essere rappresentative della popolazione di provenienza, con la quale condividono il rischio contagio. Il razionale dello studio era verificare se le persone che avevano ricevuto il vaccino, una volta rientrate nella loro routine quotidiana, mostrassero un rischio malattia diverso (sperabilmente inferiore) da quelli trattati con il placebo (il cui rischio era per definizione identico a chiunque non avesse partecipato allo studio)
I dati trapelati indicano che a partire dal settimo giorno si sono avuti 94 positivi tra i partecipanti, il 90% dei quali apparteneva al gruppo di controllo; il che spannometricamente vuol dire 86 positivi nel gruppo di controllo contro 8 del gruppo vaccinato. Da quanto emerge dal protocollo il follow up è stata fatto monitorando la comparsa di sintomi e non l'eventuale positivizzazione di soggetti altrimenti asintomatici. Comprensibile da un punto di vista operativo ma è un piccolo vulnus.
Detto in parole semplici se il vaccino non avesse funzionato, dei 94 positivi, 47 (con un delta di variabilità) avrebbero dovuto appartenere al gruppo test.
Tabella riassuntiva sulla capacità protettiva dei vaccini disponibili
I dati trapelati da coloro che hanno accesso ai dati completi post analisi (quindi unblinded) confermano che i positivi appartenevano per la quasi totalità al gruppo di controllo.
I numeri sono molto buoni ma rimangono nella mia mente alcune domande, ancora senza risposta. Alcune di queste sono tali per assenza di informazioni complete (solo chi sta analizzando il dossier le possiede), altre per la durata ancora breve dello studio clinico:
- l'endpoint è lo stato di positività che qui viene fatto coincidere con la sintomaticità e non la presenza del virus in soggetti altrimenti asintomatici. Una scelta (obbligata per ragioni pratiche) che fa perdere gli asintomatici il che a determina un certo bias nell'analisi. Se perdi i positivi non sintomatici c'è il rischio teorico di avere in giro super-diffusori vaccinati il cui rischio ricadrebbe sulla popolazione non vaccinata e sul 10% di vaccinati destinati ad ammalarsi (Nota, il punto 8.1 del protocollo pare indicare che si procede alla sola conta dei sintomatici). Anche Moderna ha seguito la stessa via, per cui i due risultati sono tra loro comparibili.
- La non positività implica anche non trasmissibilità (vuoi per titolo virale ridotto, vuoi per non "attecchimento" del virus bloccato sul nascere dagli anticorpi di pattuglia)? Parte della risposta viene anche dalla conta del numero di soggetti che sono diventati positivi poco tempo prima di ricevere la seconda dose e che (per protocollo) sono stati esclusi dallo studio.
- Dal momento della seconda dose al settimo giorno in cui sono comparsi i sintomi, quale è la finestra di protezione?
- Quanto dura la protezione? Domanda non peregrina se si pensa che il raffreddore da coronavirus (responsabili nell'adulto del 7-26% delle affezioni del tratto superiore dell'apparato respiratorio) non si associano ad una efficace protezione immunitaria post evento. A memoria ricordo un dato per cui nei bambini sono stati verificati fino a 3 episodi successivi nelle stesso mese di raffreddore causato dallo stesso virus (o forse da serotipi diversi dello stesso virus?). Altro esempio quello del vaccino influenzale che fornisce una copertura di circa 4 mesi. Questa è la ragione per cui se (come tanti poco furbamente avevano proposto) si fosse deciso di anticipare a settembre la vaccinazione, si sarebbe creata una finestra di sensibilità già a fine gennaio/inizio febbraio (vedi in proposito uno studio del 2017). Un recente articolo di ricercatori di Oxford (fatto monitorando migliaia di operatori sanitari) sembra andare contro alcuni precedenti report mostrando che gli anticorpi anti-SARSCoV2 (indice di precedente esposizione al virus) rimangono in circolo per almeno 6 mesi.
Veniamo infine ad una preoccupazione teorica ma che NON può essere accantonata.
Rischio intrinseco di qualsiasi vaccino contro un nuovo virus è il fenomeno chiamato potenziamento dipendente da anticorpi (ADE) che è correlato (in modo ancora non del tutto chiarito) ad una eccessiva risposta infiammatoria. Sia chiaro, questo non è un fenomeno associato alla vaccinazione ma avviene anche in natura con alcuni virus (vedi sotto) quando un individuo viene infettato nuovamente dopo essere guarito.
L'esempio meglio noto è quello del virus Dengue responsabile della omonima febbre. La prima volta che vieni infettato il decorso è tutto sommato lieve, in alcuni casi quasi asintomatico. Dopo il recupero, la persona è protetta dall'infezione dai restanti 3 sierotipi di dengue per 2-3 mesi. Passato questo breve periodo, la persona è nuovamente sensibile all'infezione da uno qualsiasi di questi sierotipi e questa seconda infezione ha un decorso peggiore a causa della suddetta ADE. Qualcuno ha ipotizzato che uno dei motivi per cui alcune persone, a parità di patologie pregresse, sperimentano una forma di covid19 molto più aggressiva è l'essere stati esposti in precedenza ad un coronavirus "simile che ha "settato" il sistema immunitario verso un attacco massiccio (e deleterio) per il successivo incontro con il virus (per semplicità, ma sto estremizzando, possiamo pensare alla sensibilizzazione da puntura di ape che può indurre, in alcuni soggetti, uno shock anafilattico alla successiva puntura).
Ricordo che nei pazienti con sintomatologia covid19 più grave, questo stato NON è da attribuire (solo) all'essersi imbattuti in un ceppo molto virulento, ma alla eccessiva risposta immunitaria che provoca, in primis, il collasso della funzionalità polmonare, e in seguito un deterioramento sistemico.
Tornando al vaccino mRNA, ad oggi non si ha alcuna evidenza di problematiche correlate all'ADE, tra le migliaia di volontari che hanno partecipato agli studi di fase 3 sul vaccino.
Nota 1. Gli stabilimenti produttivi di Pfizer e BioNTech in USA e Europa saranno in grado di preparare 1,35 miliardi di dosi entro la fine del 2021 (ovviamente se il vaccino verrà approvato) con un costo di circa 19 $ a dose. In questi casi non reputo corretto indignarsi per un prezzo intrinseco accusando Pharma di speculare. Sia perché la stessa cifra viene spesa per il gadget inutile di turno (e dove non possibile paga lo stato) che per una ragione ovvia: se una azienda perde oggi i soldi immessi nel processo di R&D, domani non parteciperà più allo sviluppo di farmaci che la mandano in perdita.
Nota 2. La scelta di usare come induttore immunitario la proteina S invece della N viene dalla maggiore specificità della S in quanto meno simile alla analoga proteina del virus SARS: 90% omologia nel caso della N, 77% nel caso della S (valore che scende al 66% nel caso della subunità S1). Gli anticorpi "naturali" con maggiore efficacia neutralizzante sono quelli contro la proteina S e sono sufficienti ad impedire l'aggancio del virus alla cellula.
Nota 3 (11/4/2021). Dati in arrivo da Israele sembrano indicare che il vaccino Pfizer sia meno efficace su questa variante. Il dato emerge dall'incremento di 8x della prevalenza di questa VOC tra i vaccinati infettati e i non vaccinati infettati (5,4% vs 0,7%)
***
Vaccino Moderna
A distanza di pochi giorni dai dati di Pfizer, ecco arrivare lunedì (dopo l'analisi ad interim del COVE STUDY da parte del data and safety monitoring board, costituito da analisti indipendenti) i risultati di Moderna Therapeutics.
Se i dati saranno ritenuti statisticamente validi dalla autorità regolatorie, le vaccinazioni potrebbero iniziare nella seconda metà di dicembre, con la precedenza data ai gruppi ad alto rischio (operatori sanitari, anziani e persone con patologie pregresse) mentre il resto della popolazione dovrebbe riceverlo entro la primavera.
I risultati molto positivi, con una efficacia stimata intorno al 94,5%.
Tipologia di vaccino (a RNA), di bersaglio (stabilized prefusion SARS-CoV-2 spike protein, il cui mRNA è da loro designato mRNA-1273) e protocollo clinico (studio in doppio cieco, endopoints, numero di dosi, ...) sovrapponibili allo studio di Pfizer .
I partecipanti allo studio di Moderna sono stati divisi in due gruppi, 15 mila ciascuno, uno trattato con il placebo e l'altro con il vaccino, due dosi a 28 giorni di distanza. Il monitoraggio della comparsa dei sintomatici è iniziato dopo la somministrazione della seconda dose.
Nel gruppo placebo 90 hanno sviluppato Covid-19 (11 di questi nella forma grave) una volta tornate nella loro vita quotidiana (ovvero, esposti al virus come ogni individuo della popolazione di appartenenza).
Il gruppo vaccinato ha visto invece solo 5 casi, nessuno dei quali nella forma grave.
Nessuno dei partecipanti ha riportato effetti collaterali gravi (ricordo che grave negli studi clinici si riferisce a "necessità di essere ricoverato"). Una piccola percentuale di coloro che hanno ricevuto il vaccino ha manifestato sintomi come dolori muscolari e mal di testa.
Da Moderna si fa sapere che inizierà la procedura per ottenere l'approvazione entro la fine del mese quando saranno disponibili tutti i dati relativi alla sicurezza del trattamento.
La sperimentazione in fase avanzata del vaccino Covid-19 di Moderna Therapeutics è iniziata alla fine di luglio, un traguardo notevole se si pensa che la fase 1 era iniziata a marzo.
Dato non secondario, Moderna ha ottenuto fonti federali per 955 milioni di dollari di impegni all'acquisto da parte della Biomedical Advanced Research and Development Authority (BARDA).Un finanziamento che i contribuenti americani, diversi da quelli europei abituati a vedere i soldi statali scomparire sotto voci di bilancio tra le più fantasiose, tengono sotto attento monitoraggio, per il quale si aspettano un "dividendo" (vaccino pronto all'uso) o in subordine la totale restituzione dei fondi allocati.
Come quello di Pfizer (e tanti altri sul Covid) il vaccino Moderna si basa sulla tecnologia mRNA ma rimangono punti oscuri (per quanto ne so) sul veicolo anche se è praticamente certo che sia basato su nanoparticelle lipidiche - LNP (Moderna ha provato, senza successo, a contestare un brevetto di proprietà della canadese Arbutus Biopharma - ABUS 0,0% - correlato alla tecnologia delle nanoparticelle lipidiche ... e alle coincidenze nessuno qui crede).
Moderna non è una novellina nel campo. Per un decennio l'azienda (sotto la guida di Stephane Bancel, il CEO) ha lavorato per sviluppare la tecnologia mRNA con il fine di riuscire a rendere le cellule stesse dell'organismo da curare le produttrici del farmaco. Affinché l'approccio funzioni, il carrier deve trasportare in modo sicuro l'mRNA alle cellule del corpo senza che il carico utile si liberi inutilmente nel flusso sanguigno.
A giugno, i ricercatori del NIH e di Moderna hanno depositato sulla piattaforma bioRxiv un manoscritto con i dati preclinici ottenuti dai test con mRNA-1273. Nel preprint viene descritto il vaccino anti-covid19 in cui si sfrutta come veicolo la tecnologia nanosomica di proprietà del brevetto Arbutus (ma secondo Moderna il claim del brevetto non copre questo particolare utilizzo). Ovviamente quanto scritto nell'articolo e quanto poi usato nello studio clinico potrebbero essere molto diversi (vedi sotto).
In verità il precedente non è l'unico articolo da loro pubblicato sul tema. Già nel 2019 si trova uno studio simile (pubblicato sulla prestigiosa rivista NEJM) finalizzato al trattamento della SARS, il cui virus è strettamente imparentato con l'attuale responsabile del covid19. Già allora si parlava di un veicolo di tipo LNP.
Se andiamo poi a controllare la descrizione dello studio di fase 1 sul vaccino contro il coronavirus di Moderna disponibile nei database clinici USA, si troverà l'informazione che l'LNP per mRNA-1273 è composto da: lipide cationico ionizzabile; colesterolo; fosfolipide e un lipide anti-aggregazione coniugato basato sul PEG. Non vengono però rivelati (o meglio non in chiaro perché ovviamente l'informazione deve essere presente) i rapporti molari tra le varie componenti.
Le dichiarazioni ufficiali della società farmaceutica affermano che sono andati oltre la tecnologia sviluppata da Arbutus, già a partire dal 2016, in quanto "ok ma non ottimale".
Perché questo dato dovrebbe interessare?
Per motivi pratici. Le condizioni di conservazione dei 2 vaccini sono piuttosto diverse:
- Il vaccino di Moderna richiede una conservazione a lungo termine a -20 °C ed è stabile per 30 giorni tra 2-8 °C.
- Il vaccino di Pfizer/BioNTech necessita -70 °C.
Una volta che un vaccino si è riscaldato, rimane utilizzabile solo per pochi giorni.
-20 °C vs -70 °C non è un dettaglio. Fa un'enorme differenza quando devi occuparti della spedizione e dello stoccaggio. Pfizer ha affermato in tale ambito di avere la soluzione grazie allo sviluppo di contenitori termici progettati appositamente, basati sul ghiaccio secco, in grado di mantenere le condizioni di temperatura raccomandate per un massimo di 10 giorni. Ciascun contenitore è in grado di trasportare fino a 5 mila dosi.
***
Per prepararsi all'enorme sforzo logistico, la produzione del vaccino Covid-19 è già in corso. L'idea è che una volta ottenuto (sempre che avvenga) il via libera, le dosi devono essere pronte alla distribuzione. Sebbene lo stoccaggio nelle strutture principali (cioè i magazzini regionali prima e i grandi ospedali poi) non sia un grosso problema, se si vuole che questo venga gestito anche in strutture periferiche (ad esempio le strutture periferiche) le due temperature di stoccaggio fanno la differenza.
Ogni volta che il vaccino si muove dai magazzini centrali viene introdotto un fattore di rischio intrinseco allo spostamento: il maltempo può ritardare i voli; i congelatori sui camion refrigerati possono guastarsi; i camion possono trovarsi bloccati in ingorghi imprevisti; i contenitori possono non essere perfetti; ... . Anche solo aprire ripetutamente i congelatori per spostare i prodotti in arrivo e in uscita può danneggiare i vaccini. Ogni violazione del controllo della temperatura degrada il vaccino e ogni volta che il vaccino si sposta, le possibilità che ciò accada aumentano, quindi i funzionari sanitari devono pianificare il tutto in modo preventivo e tenere traccia di ogni anomalia.
Nota. Questo non e' un optional ma un obbligo (prevenire i problemi attraverso analisi dei punti critici) che ogni azienda deve pianificare in anticipo e per cui vieni valutato. Lo spazio di "non era prevedibile" è difficilmente accettato come scusa sia dalle autorità di vigilanza che dal tuo stesso board.
Ulteriore complicazione è che entrambi i vaccini richiedono due dosi, distanziate di alcune settimane tra loro. Tradotto, vuol dire raddoppiare la capacità gestionale.
Fonti
- An mRNA Vaccine against SARS-CoV-2 — Preliminary Report
Lisa A. Jackson et al, N Engl J Med 2020; 383:1920-1931
- Forbes
- Vox.com
- NIH/news
***
Quale dei due è il migliore? Difficile fare previsioni con i pochi dati a disposizione ma un aiuto viene dal confronto tra i due titoli azionari il cui trend rivela le opinioni degli analisti.
 |
| Moderna (mRNA) vs Pfizer (PFE). Ricordo che il valore "in questo momento"(12/20) non rispecchia o predice il trend futuro. Per cui è sempre sconsigliato "seguire il gregge" comprando azioni sulle performance passate. Per avere le quotazioni aggiornate vi rimando alla pagina su finance.yahoo |
***
Non solo Pfizer/BioNTech e Moderna. Ci sono altri vaccini, alternativi/complementari, in fase di sviluppo contro il Sars-CoV-2. Di seguito un grafico riassuntivo di tutti gli studi in corso
 | |
| L'articolo da cui ho tratto la figura fornisce un ottimo compendio di quanti e quali vaccini sono in fase di sviluppo (image credit & original article --> news.sky.com). Dalla figura si nota che quello di Pfizer non e' il primo vaccino approvato per l'uso, primato che va ad un prodotto russo (nota. Approvato in Russia, non altrove, lo scorso agosto saltando a pie pari la fase 2) |


Nessun commento:
Posta un commento