Terapia sperimentale con nanoparticelle si è dimostrata capace, nei topi, di attenuare (e in parte invertire) la malattia di Alzheimer (AD).
A differenza della nanomedicina tradizionale, che si basa sull'utilizzo di nanoparticelle come vettori per il trasporto in situ di molecole terapeutiche, l'approccio provato in questa sperimentazione è stato usare nanoparticelle bioattive o farmaci supramolecolari (italianizzazione del termine originale).
Il lavoro è stato pubblicato sulla rivista Signal Transduction and Targeted Therapy.
L'approccio terapeutico non aveva come obiettivo i neuroni ma era mirato a ripristinare il corretto funzionamento della barriera emato-encefalica (BBE, vedi nota fondo pagina), la struttura vascolare che regola lo scambio di nutrienti e fornisce protezione all'ambiente cerebrale (condizioni locali e da ingresso di molecole indesiderate o patogeni). In seguito alla riparazione di questa interfaccia è stato osservato un miglioramento dei sintomi principali della malattia in modelli murini per la AD.
Per funzionare al meglio, il cervello (area dell'organismo che consuma molta energia e risorse) necessita di un afflusso costante di sangue che viene regolato finemente nei suoi distretti microscopici in base all'attività locale, dove un singolo capillare si prende cura di uno o pochi neuroni.
L'anatomia del cervello con il suo miliardo di capillari, ben evidenzia il ruolo vitale della vascolarizzazione nel mantenere la funzionalità ottimale, pena malattie fortemente invalidanti come ben evidenziato dalle conseguenze dell'ictus.
In questo ambito di controllo accurato, centrale è il ruolo della BEE, una barriera cellulare e fisiologica che separa il cervello dal flusso sanguigno, proteggendolo da pericoli esterni come patogeni e tossine.
Gli autori dello studio hanno mostrato gli effetti positivi successivi al ripristino dei sistemi che permettono alle "proteine di scarto" prodotte nel cervello di attraversare questa barriera, finendo nel flusso sanguigno e da lì alla loro eliminazione, e i danni che si accumulano quando la "pulizia" viene meno. Nel morbo di Alzheimer, la principale proteina di "scarto" è la beta-amiloide, il cui accumulo compromette il normale funzionamento dei neuroni.
Rimando ad articoli precedenti l'importante e irrisolto dibattito sulla centralità della ipotesi amiloide rispetto ad altre ipotesi sull'origine della malattia. Vedi "amiloide o lisosomi?" e "ruolo del colesterolo nell'AD".
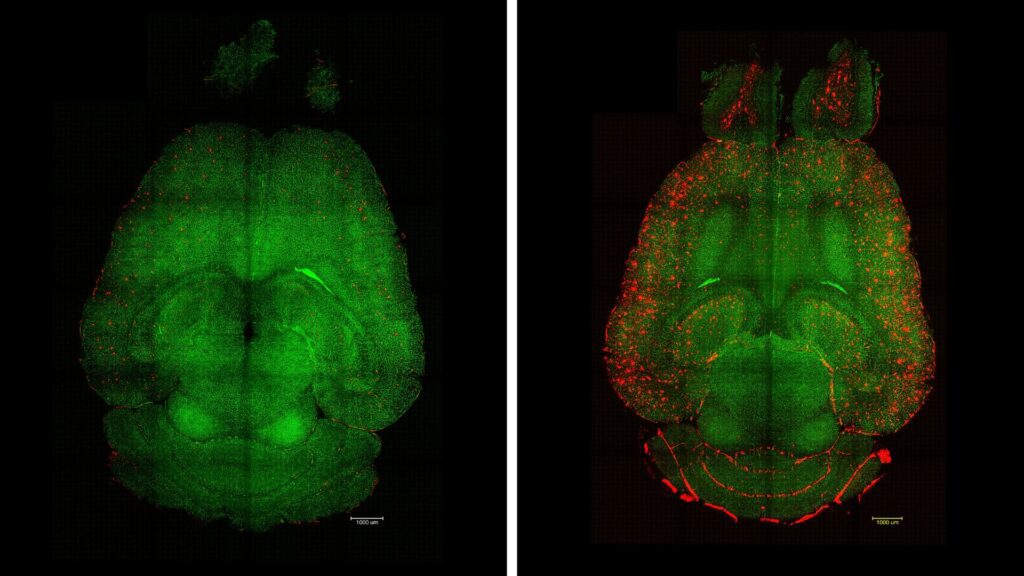
Lo studio si è avvalso di topi geneticamente modificati che producono alti livelli di beta amiloide, condizione che innesca un progressivo declino cognitivo che mima la AD.
Nella malattia di Alzheimer, uno dei problemi principali è che il sistema naturale di eliminazione delle proteine tossiche come la beta-amiloide è poco o nulla efficiente. Nei soggetti sani è la proteina LRP1 a svolgere un ruolo chiave: riconosce e lega la beta amiloide, trasportandola attraverso la BEE nel flusso sanguigno, dove viene veicolata ai centri di eliminazione. Il sistema è però fragile: se LRP1 lega troppa beta amiloide (o il legame è troppo forte), il trasporto si blocca e la proteina LRP1 stessa viene degradata all'interno delle cellule della barriera cerebrale, lasciando meno trasportatori di LRP1 disponibili.
D'altra parte, se si lega troppo poco, il segnale è troppo debole per innescare il trasporto.
I topi sintomatici sono stati trattati con le suddette nanoparticelle monitorando nel tempo, rispetto ai controlli non trattati, l'evoluzione della malattia attraverso vari test.
In uno dei test il topo trattato di 12 mesi (equivalente a un essere umano sintomatico di 60 anni) recuperava nel giro di 6 mesi i tratti comportamentali di un topo sano grazie al ripristino della vascolarizzazione cerebrale e alla rimozione della beta-amiloide dal cervello.
I farmaci supramolecolari sviluppati dai ricercatori agiscono come un interruttore che resetta il sistema. Imitano funzionalmente i ligandi di LRP1, legando il trasportatore riavviando il trasporto attraverso la barriera emato-encefalica ripristinando "l'ingranaggio bloccato"
Nota. La BEE è costituita da una combinazione di cellule (endoteliali, periciti, astrociti) e strutture (membrana basale) che formano un filtro altamente selettivo tra il sangue e il cervello. Anche alle cellule immunitarie è precluso l'ingresso per evitare di innescare infiammazione nel cervello.Le molecole ad accesso libero (diffusione passiva) sono acqua, ossigeno, CO2 e molecole liposolubili e ormoni steroidei.Altre molecole importanti necessitano invece di trasportatori specifici (meccanismi attivi). Questo è il caso del glucosio, aminoacidi essenziali, nucleosidi, alcune vitamine idrosolubili.Tra i meccanismi che espellono molecole verso il flusso sanguigno il più importante è quello mediato dalla P-glicoproteina
Fonte
- Multivalent modulation of endothelial LRP1 induces fast neurovascular amyloid-β clearance and cognitive function improvement in Alzheimer’s disease models
Junyang Chen et al (2025) Signal Transduction and Targeted Therapy
***
Vi invito ad usare (anche) Bing e la IA come motore di ricerca. Oltre a ricerche particolareggiate godrete di accumulo punti utili per riscattare premi.
Qui il link di invito https://rewards.bing.com/welcome?rh=21D89F56&ref=rafsrchae