Il sistema riproduttivo maschile è in un certo senso un hotspot di innovazione da cui (sul lunghissimo periodo) possono emergere anche nuovi geni. Le mutazioni di origine paterna (beninteso quelle che non alterano la funzionalità spermatica e che non diminuiscono la vitalità embrionale) sono infatti più frequenti di quelle materne.
Fatto noto, ma meccanicisticamente poco compreso, è che l’età avanzata del padre aumenta il rischio di trasmettere mutazioni alla progenie.
Un recente studio pubblicato su Nature Ecology & Evolution da ricercatori della Rockefeller University ha indagato il suddetto fenomeno usando come modello animale la Drosophila (moscerino della frutta), modello classico per studi di genetica, con il quale si spera di ricavare informazioni sul rischio di malattie ereditarie negli esseri umani.
Altro vantaggio di usare Drosophila è il loro elevato (e rapido) tasso di riproduzione, che permette di analizzare l’effetto di ciascun mutante anche nella “vecchiaia” e su più generazioni.
Va da sé che il processo studiato è la spermatogenesi, la produzione di spermatozoi dalle cellule germinali. I ricercatori hanno scoperto che in realtà il tasso di mutazioni non cambia nei testicoli dei moscerini giovani e anziani ma le mutazioni fissate alla fine del processo sono maggiori in quelli anziani, come se queste fossero state identificate e rimosse durante lo sviluppo spermatico nei giovani.
La prima, ovvia, ipotesi fu che il sistema di rilevazione e/o di riparazione del DNA perdesse di efficienza con l’età o magari i progenitori germinali negli “anziani” avessero di partenza un maggior carico mutazionale.
Entrambe le ipotesi si rivelarono corrette dato che ci sono più mutazioni per ogni gene nelle mosche più vecchie che nelle mosche più giovani.
Tenere “in ordine” il genoma è già un compito complesso, e lo è ancora di più quando ad essere coinvolte sono le cellule germinali maschili che, per la loro funzione, sono ad altissimo ricambio. A questo si aggiunga che nei testicoli vi è un tasso di espressione genica (nel senso di numero di geni attivi) più alta che in qualunque altro distretto corporeo.
Per quanto apparentemente controintuitivo (in fondo il compito della spermatogenesi è formare gameti mediante il processo meiotico, e produrre il maggior numero di spermatozoi, non “costruire” o svolgere funzioni complesse) c’è una ragione per comprendere tale massiccia attività trascrizionale dei geni: una sorta di meccanismo di sorveglianza genomica che permette di rilevare subito le mutazioni problematiche (prodotto proteico non funzionante ad esempio). Un dato confermato dal fatto che i geni effettivamente espressi (quindi "valutati") durante la spermatogenesi hanno un tasso di mutazione alla fine del processo di maturazione, inferiore rispetto ai geni non trascritti.
Gli spermatozoi nei moscerini anziani (ricordo che la vita media della Drosophila è 70 giorni) hanno un calo di efficienza proprio nei geni attivi e questo fa pensare che la colpa sia in una ridotta efficienza del sistema di riparazione associato alla trascrizione.
Lo studio si è basato sul sequenziamento di RNA da singola cellula prelevate dai testicoli di circa 300 moscerini, metà dei quali giovani (48 ore) e il rimanente vecchi (25 giorni).
Nota. QUI maggior dettagli sulla tecnica di single cell sequencing. La scelta di usare RNA invece di RNA per ottenere informazioni genetiche permette di focalizzarsi sui geni attivi. Utilizzare le informazioni da una singola cellula permette inoltre di evitare il rischio concreto di diluizione dell’informazione sia perché le cellule mutate sono rare che per il fatto che nel processo di estrazione delle delle cellule dai testicoli si prendono vari tipi cellulari, ognuna con un proprio profilo di espressione; mettere tutto in un unico calderone annacquerebbe i dati.
Per capire se le mutazioni rilevate fossero somatiche (ereditate dai genitori) o de novo (comparse nella linea germinale) si è usato come riferimento il genoma (cioè il DNA) di ciascun moscerino.
Il passo successivo sarà espandere l’analisi a più gruppi di età e confermare che le anomalie siano causate dal meccanismo di riparazione associato alla trascrizione (e nel caso verificare le ragioni di questa perdita di efficienza). Rimane anche da capire se una linea germinale (maschile) più a rischio di mutazioni abbia un reale impatto sulla fertilità.
Un dato di estremo interesse negli umani per rispondere al quesito se i figli concepiti da padri anziani siano portatori di più mutazioni e se siano a maggior rischio (anche solo per ragioni di epigenetica, quindi in assenza di mutazioni) di sviluppare malattie (anche genetiche) e alcuni tipi di cancro.
In calce copio un precedente articolo su temi correlati cioè "I padri adolescenti hanno rischio maggiore di trasmettere mutazioni?"
Fonte
- Transcriptional and mutational signatures of the Drosophila ageing germline.
Evan Witt et al, (2023) Nature Ecology & Evolution
***
I figli di padri adolescenti sono più a rischio mutazioni di quelli concepiti da (padri) adulti?
Limitiamoci qui al maschio, che è il tema centrale dell'articolo a cui faccio riferimento.
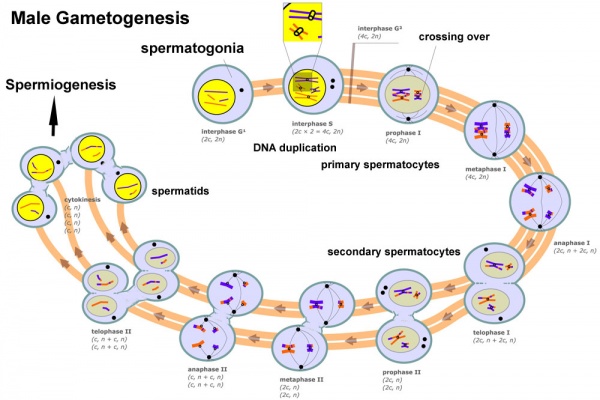
Da quanto scritto prima è chiaro che per mantenere costante il numero di spermatogoni e alimentare la linea differenziativa che attraverso gli spermatociti porterà agli spermatozoi (durante la quale non avvengono più divisioni mitotiche) è necessaria una continua divisione cellulare delle cellule "sorgente". Una divisione che deve al tempo stesso mantenere costante il numero di cellule indifferenziate e assicurare il costante rifornimento di cellule germinali mature.
Eppure …
... una ricerca pubblicata su "Proceedings of the Royal Society B" rivela che gli spermatozoi degli adolescenti hanno un tasso di mutazione 6 volte superiore a quello delle ragazze (e fin qui ok, dato che il carico mitotico è diverso) ma anche superiore a quello dei ventenni e paragonabile a quello dei loro padri.
Da questo semplice sillogismo deriva che la progenie di padri adolescenti è più a rischio mutazione di quella di padri adulti e questo potrebbe spiegare alcune frequenze anomale di malattie con base genetica (ma non necessariamente familiare, quindi alterazioni ex novo) come l'autismo, la schizofrenia e la spina bifida (in quest'ultimo caso l'acido folico è un fondamentale strumento preventivo - ma non assoluto - specifico per i deficit nutrizionali e non genetici).
Come bonus dell'articolo un bel video (200 frame al secondo) che mostra il movimento di uno spermatozoo all'interno di un struttura che mima l'apparato genitale femminile. Solo le cellule spermatiche migliori riescono ad arrivare alla metà. Un esempio della selezione che elimina molte delle cellule mutate.
Il campo di studio è tuttavia lungi dall'essere compreso nei dettagli a causa del numero di variabili coinvolte. Lo dimostra uno studio condotto dalla Georgetown University in cui vengono sottolineati i fattori di rischio associati ad un padre "maturo"; ne parlerò più dettaglio nel prossimo articolo.
Fonte
L'essenza del pensiero scientifico si manifesta anche nel valutare articoli (ovviamente pubblicati su riviste serie) che vanno contro le idee acquisite; un processo che incentiva a ripensare la tematica affrontata, spingendo a rivedere i dati precedenti.
Finora nessuno (dal genetista al semplice curioso di scienza) avrebbe mai avuto molto da ridire circa il fatto che le cellule germinali di un adolescente sono meno "alterate" rispetto a quelle di un adulto. E non mi riferisco soltanto alla migliore efficienza riproduttiva legata al migliore stato fisiologico di un giovane in piena salute rispetto al cinquantenne medio. Parlo di "alterazioni" in senso letterale, cioè dell'informazione genetica, quindi di mutazioni.
Le cellule germinali aploidi derivano da una serie di divisioni cellulari a carico di cellule progenitrici diploidi che culminano nel processo meiotico da cui emergeranno le cellule mature (oociti o spermatozoi).
Le cellule germinali aploidi derivano da una serie di divisioni cellulari a carico di cellule progenitrici diploidi che culminano nel processo meiotico da cui emergeranno le cellule mature (oociti o spermatozoi).
 |
| Il processo di maturazione degli spermatozoi nei testicoli 1 lamina basale, 2 spermatogonia, 3/4 spermatociti di 1° e 2° ordine, 5/6 spermatidi e spermatozoi maturi, 7 Cellule del Sertoli, 8 tight junction (barriera sangue-testicoli) |
Maschi e femmine (limitiamoci per semplicità ai mammiferi) producono durante la loro vita riproduttiva, un numero di cellule molto diverso. Il numero di cellule germinali prodotte dai maschi ha dell'incredibile: tra 40 e 200 milioni di cellule al giorno per tutta la durata della vita adulta (alias sessualmente matura); le femmine sono più parsimoniose e nel caso della specie umana gli oociti che giungono a maturazione sono (in media) uno ogni mese (per chi volesse approfondire l'argomento --> spermatogenesi e oogenesi).
Limitiamoci qui al maschio, che è il tema centrale dell'articolo a cui faccio riferimento.
Da quanto scritto prima è chiaro che per mantenere costante il numero di spermatogoni e alimentare la linea differenziativa che attraverso gli spermatociti porterà agli spermatozoi (durante la quale non avvengono più divisioni mitotiche) è necessaria una continua divisione cellulare delle cellule "sorgente". Una divisione che deve al tempo stesso mantenere costante il numero di cellule indifferenziate e assicurare il costante rifornimento di cellule germinali mature.
Tanto più sono le divisioni cellulari, tanto maggiore è il lavoro di duplicazione del DNA e di rimando la probabilità che vi sarà un errore di copiatura del DNA, cioè la mutazione.
Da questo concetto lineare deriva che le cellule germinali di un adolescente maschio dovrebbero essere meno alterate di quelle di un adulto. Ovvio, no? Un dato che trova riscontri nella realtà con il fatto che la prole di maschi anziani ha una maggiore incidenza di alcune patologie.Le mutazioni sono il risultato congiunto di errori di copiatura del DNA durante la divisione cellulare e di alterazioni chimiche causate sia da agenti ambientali standard (radiazioni, ossigeno, radicali liberi, etc) che dal normale metabolismo cellulare. La riparazione dei danni del DNA è un processo generalmente molto efficiente e ridondante (esistono cioè meccanismi diversi che si occupano di scoprire e correggere i danni in tutte le fasi del ciclo cellulare) ma la forza dei numeri (numero di cellule, numero di divisioni, entità dello stress ambientale, etc) fa si che ci sia sempre qualche alterazione che sfugge al controllo di qualità, fissandosi così nel genoma. Se la mutazione avviene in una cellula germinale il rischio associato alla mutazione può essere trasmessa alle generazioni successive.
Eppure …
... una ricerca pubblicata su "Proceedings of the Royal Society B" rivela che gli spermatozoi degli adolescenti hanno un tasso di mutazione 6 volte superiore a quello delle ragazze (e fin qui ok, dato che il carico mitotico è diverso) ma anche superiore a quello dei ventenni e paragonabile a quello dei loro padri.
Da questo semplice sillogismo deriva che la progenie di padri adolescenti è più a rischio mutazione di quella di padri adulti e questo potrebbe spiegare alcune frequenze anomale di malattie con base genetica (ma non necessariamente familiare, quindi alterazioni ex novo) come l'autismo, la schizofrenia e la spina bifida (in quest'ultimo caso l'acido folico è un fondamentale strumento preventivo - ma non assoluto - specifico per i deficit nutrizionali e non genetici).
I ricercatori hanno dimostrato che all'inizio della fase puberale il carico replicativo delle cellule germinali maschili è maggiore di quanto finora stimato: 150 divisioni cellulari (invece delle 30 attese) contro le 22 di quelle nella femmina.
Anche qui la conclusione che emerge è ovvia, cioè il maschio adolescente è di per sé più a rischio (per il numero di mutazioni potenzialmente trasmessibili allo zigote) di quanto lo sia la madre adolescente. Un rischio maggiore derivante dal maggior carico mitotico delle cellule progenitrici.
E' necessario tuttavia pesare l'impatto che una mutazione ha sulla fitness della cellula germinale alterata, diverso nei maschi e nelle femmine. Le cellule maschili sono sottoposte ad una maggiore pressione selettiva nelle fasi immediatamente precedenti la fecondazione di un oocita. Una vera e propria "corsa ad ostacoli" che di fatto screma gran parte delle mutazioni dannose per la fisiologia cellulare (o semplicemente che rendono la cellula meno performante).
Anche qui la conclusione che emerge è ovvia, cioè il maschio adolescente è di per sé più a rischio (per il numero di mutazioni potenzialmente trasmessibili allo zigote) di quanto lo sia la madre adolescente. Un rischio maggiore derivante dal maggior carico mitotico delle cellule progenitrici.
E' necessario tuttavia pesare l'impatto che una mutazione ha sulla fitness della cellula germinale alterata, diverso nei maschi e nelle femmine. Le cellule maschili sono sottoposte ad una maggiore pressione selettiva nelle fasi immediatamente precedenti la fecondazione di un oocita. Una vera e propria "corsa ad ostacoli" che di fatto screma gran parte delle mutazioni dannose per la fisiologia cellulare (o semplicemente che rendono la cellula meno performante).
Pur tenendo in considerazione questo aspetto, se si misura il tasso di mutazione nelle cellule maschili (6 volte superiore) e lo si somma al maggior numero di divisioni cellulari allora il fattore rischio torna a pendere verso il maschio.
Dato che non parliamo "solo" di numero complessivo di mutazioni ma di tasso di mutazione, la domanda chiave è per quale motivo il tasso sia maggiore nei maschi adolescenti è ignoto. Al momento ci sono solo ipotesi, tra cui quella che forse il numero di divisioni cellulari maschili è maggiore di quanto stimato (e questo modifica la stima del tasso reale) oppure che i meccanismi di correzione degli di errori di copiatura sia per qualche motivo meno efficiente durante la pubertà.
Dato che non parliamo "solo" di numero complessivo di mutazioni ma di tasso di mutazione, la domanda chiave è per quale motivo il tasso sia maggiore nei maschi adolescenti è ignoto. Al momento ci sono solo ipotesi, tra cui quella che forse il numero di divisioni cellulari maschili è maggiore di quanto stimato (e questo modifica la stima del tasso reale) oppure che i meccanismi di correzione degli di errori di copiatura sia per qualche motivo meno efficiente durante la pubertà.
Qualunque sia la ragione, il dato che emerge è che le cellule spermatiche degli adolescenti hanno frequenze di mutazione superiori del 30% a quelle dei ventenni, paragonabili a quelle di uomini intorno ai quarant'anni.
Lo studio, condotto su oltre 24 mila soggetti tra genitori e figli (ovviamente biologici) di diversa origine geografica ed età, ha monitorato la comparsa di mutazioni in regioni del DNA note come microsatelliti, sequenze ripetitive di DNA che non essendo codificanti non sono soggette ad una selezione funzionale della cellula e quindi mostrano il dato grezzo del tasso di mutazione.
E' importante sottolineare che l'aumentata frequenza di mutazioni NON si traduce linearmente in una aumentato fattore di rischio, dato che per essere potenzialmente rischiosa la mutazione deve colpire regioni importanti del gene (codificanti o regolatorie).
In conclusione la stima del rischio per la progenie di un padre adolescente è circa il 2% contro l'1,5% di un ventenne.
In conclusione la stima del rischio per la progenie di un padre adolescente è circa il 2% contro l'1,5% di un ventenne.
Come bonus dell'articolo un bel video (200 frame al secondo) che mostra il movimento di uno spermatozoo all'interno di un struttura che mima l'apparato genitale femminile. Solo le cellule spermatiche migliori riescono ad arrivare alla metà. Un esempio della selezione che elimina molte delle cellule mutate.
Credit: "Female reproductive tract assists swimming sperm" - Cornell University
(In caso di problemi di visualizzazione del video cliccate su https://www.cornell.edu/video/sperm-swim-microfluidic-device-mimics-female-reproductive-tract)
Il campo di studio è tuttavia lungi dall'essere compreso nei dettagli a causa del numero di variabili coinvolte. Lo dimostra uno studio condotto dalla Georgetown University in cui vengono sottolineati i fattori di rischio associati ad un padre "maturo"; ne parlerò più dettaglio nel prossimo articolo.
Fonte
- Elevated germline mutation rate in teenage fathers
Peter Forster et al, (2015) Proceedings of the Royal Society B

Nessun commento:
Posta un commento