Introduzione
La terapia genica è una tecnologia il cui fine è ripristinare la normale funzionalità di un gene attraverso la correzione di una o più alterazioni geniche.
La natura di queste ultime determina l'approccio "ideale" per il lavoro di editing genomico: se nel caso delle mutazioni puntiformi si può ipotizzare di correggere "la sintassi genica" su una o entrambe le copie presenti, nel caso di alterazioni più estese (ivi comprese duplicazioni e delezioni) bisognerà agire in modo altrettanto esteso. Ad esempio nel caso di una delezione si potrebbe pensare di inserire la porzione mancante su un mini cromosoma artificiale mentre nel caso di duplicazioni l'ideale sarebbe rimuovere "l'informazione in eccesso" fisicamente o spegnerla funzionalmente (ad esempio mediante RNA silencing). Da un punto di vista teorico si potrebbe persino ipotizzare di spegnere il cromosoma 21 in eccesso nei pazienti trisomici (sindrome di Down) minimizzando così i gravi problemi di salute associati a tali condizioni.
Un approccio simile potrebbe essere utilizzato nel trattamento di neoplasie, la cui eziogenesi vede come elemento centrale la perdita di una o entrambe le copie di geni regolatori critici per proliferazione cellulare e apoptosi.
Un tale approccio implica l'utilizzo di "armi intelligenti" capaci di scovare e modificare (o uccidere a seconda dei casi) solo le cellule bersaglio sperdute tra milioni di consimili normali.
I progressi fatti negli ultimi 60 anni (da quando cioè si è scoperto il DNA e compresa la sua funzione) ci permettono oggi di "pescare" una cellula con le caratteristiche cercate e di visualizzarla (vedi a tal proposito le tecniche di imaging con marcatori fluorescenti o radioattivi). Su queste basi si sono sviluppate metodiche che oltre ad identificare il bersaglio lo "usano" come luogo in cui scaricare le molecole di interesse, siano esse delle tossine, proteine o acidi nucleici.
Due sono i vettori tradizionalmente usati per trasportare le suddette molecole: nanosfere lipidiche e virus. I virus, opportunamente modificati per renderne impossibile la replicazione (e di fatto privati di quasi ogni gene virale), rappresentano lo strumento più "naturale" per svolgere il compito di traghettatore di "geni utili".
Terapia genica e diabete
La terapia genica è una tecnologia il cui fine è ripristinare la normale funzionalità di un gene attraverso la correzione di una o più alterazioni geniche.
Un approccio simile potrebbe essere utilizzato nel trattamento di neoplasie, la cui eziogenesi vede come elemento centrale la perdita di una o entrambe le copie di geni regolatori critici per proliferazione cellulare e apoptosi.
Un tale approccio implica l'utilizzo di "armi intelligenti" capaci di scovare e modificare (o uccidere a seconda dei casi) solo le cellule bersaglio sperdute tra milioni di consimili normali.
I progressi fatti negli ultimi 60 anni (da quando cioè si è scoperto il DNA e compresa la sua funzione) ci permettono oggi di "pescare" una cellula con le caratteristiche cercate e di visualizzarla (vedi a tal proposito le tecniche di imaging con marcatori fluorescenti o radioattivi). Su queste basi si sono sviluppate metodiche che oltre ad identificare il bersaglio lo "usano" come luogo in cui scaricare le molecole di interesse, siano esse delle tossine, proteine o acidi nucleici.
Due sono i vettori tradizionalmente usati per trasportare le suddette molecole: nanosfere lipidiche e virus. I virus, opportunamente modificati per renderne impossibile la replicazione (e di fatto privati di quasi ogni gene virale), rappresentano lo strumento più "naturale" per svolgere il compito di traghettatore di "geni utili".
E' l'evoluzione stessa di un virus ad averlo reso lo strumento più efficiente per scovare le cellule dotate di caratteristiche (recettori e "armamentario" proteico) specifiche. Un esempio banale della loro specificità è quello del virus del raffreddore incapace non solo di infettare i nostri amici a quattro zampe ma anche di interagire con cellule diverse da quelle epiteliali della mucosa respiratoria.Nell'ultimo biennio è assurto agli onori della cronaca una nuova metodica di editing genetico (copiata pari pari dal sistema di difesa batterico contro i virus) nota come sistema CRISPR/Cas.
Terapia genica e diabete
 Le malattie "ideali" per essere "riparate" con strumenti di editing genico sono quelle semplici, vale a dire quelle causate da una singola mutazione. Il diabete giovanile d'altro canto non ha queste caratteristiche essendo il risultato di cause ambientali poco note e di una certa predisposizione genetica; il risultato netto è una reazione autoimmune che porta alla distruzione delle cellule del pancreas deputate alla produzione di insulina.
Le malattie "ideali" per essere "riparate" con strumenti di editing genico sono quelle semplici, vale a dire quelle causate da una singola mutazione. Il diabete giovanile d'altro canto non ha queste caratteristiche essendo il risultato di cause ambientali poco note e di una certa predisposizione genetica; il risultato netto è una reazione autoimmune che porta alla distruzione delle cellule del pancreas deputate alla produzione di insulina.Quando il numero di cellule sopravvissute scende al di sotto di un certo numero, la quantità di insulina prodotta non è più sufficiente per garantire l'omeostasi energetica (l'insulina stimola l'ingresso del glucosio ematico nelle cellule ... oltre a molte altre funzioni) arrivando al paradosso di cellule affamate sebbene immerse in un ambiente iperglicemico.
L'idea terapeutica, alternativa alla somministrazione dell'insulina, è di "convincere" le altre cellule dell'organismo a farsi carico della produzione dell'insulina.
Tra gli articoli di rilievo sul tema vale la pena citare quello prodotto da un team dell'ospedale San Raffaele di Milano coordinato da Maria Grazia Roncarolo e pubblicato su Science Translational Medicine.
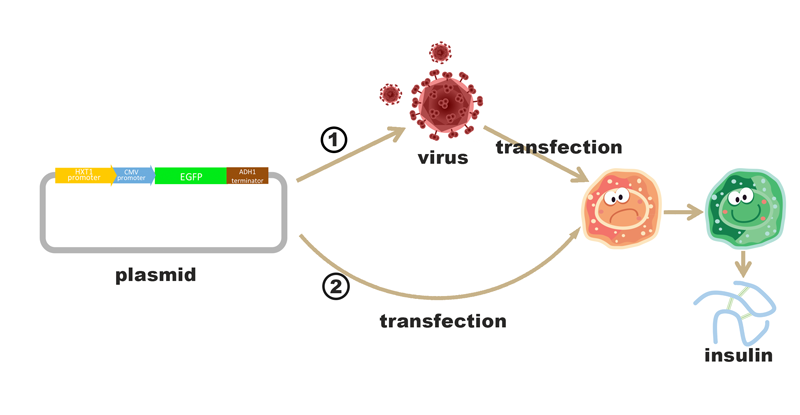
Il modello sperimentale usato dai ricercatori italiani è quello di topi predisposti al diabete ai quali è stato somministrato un virus modificato per trasportare il gene dell'insulina. A differenza di approcci simili testati su altre malattie, qui le cellule bersaglio "da modificare" non erano quelle "epicentro" della malattia ma le cellule epatiche. Il motivo è ovvio: dato che le cellule produttrici di insulina sono state distrutte dall'azione autoimmune non avrebbe alcun senso trasferire un gene già presente nelle poche cellule ancora vive. Indurre la produzione di insulina in cellule normalmente incapaci di produrla ha invece senso tanto più che le cellule epatiche non sono il bersaglio della risposta autoimmune e quindi il trattamento ha una buona probabilità di essere risolutivo.
La domanda ovvia è "perché inserire un nuovo gene per l'insulina se, come ovvio, le cellule epatiche hanno tutte le informazioni necessarie (il gene) per produrre la proteina?" Il motivo è che l'espressione genica è finemente regolata in modo tale che i geni giusti vengano espressi non solo nella cellula giusta ma anche al momento giusto. Una cellula muscolare che iniziasse a produrre cheratina avviando il processo di corneificazione (tipico delle cellule epiteliali della cute) non solo non trarrebbe alcuna vantaggio ma indurrebbe seri problemi funzionali a livello sistemico.
Se si vuole "convincere" una cellula epatica ad attivare la trascrizione di un gene normalmente silente due sono le possibilità: alterare i meccanismi regolatori che tengono spento il gene per l'insulina; introdurre un nuovo gene (utilizzando un virus come trasportatore) per l'insulina sotto il controllo di un sistema di regolazione specifico e non in conflitto con la funzionalità della cellula.
Facile capire come il metodo a minor impatto (e privo di imprevedibili effetti a cascata) sia il secondo, quello utilizzato in effetti dal team italiano.
Riassumendo i risultati in due righe, il trattamento ha avuto un esito ben superiore alle attese: non solo gli epatociti modificati hanno cominciato a produrre insulina (quando necessario) ma si è anche attivato un meccanismo di modulazione della risposta immunitaria, mediata dai linfociti T regolatori, che ha fermato il processo infiammatorio a carico del pancreas spegnendo le cellule immunitarie coinvolte.
Non bastasse, i ricercatori sono stati in grado di migliorare l'efficacia del trattamento mediante la somministrazione di un anticorpo specifico contro la proteina CD3 (che nei linfociti T si associa al recettore TCR ed è necessario per l'attivazione degli stessi) con il risultato di bloccare la progressione della malattia nei topi diabetici.
Non bastasse, i ricercatori sono stati in grado di migliorare l'efficacia del trattamento mediante la somministrazione di un anticorpo specifico contro la proteina CD3 (che nei linfociti T si associa al recettore TCR ed è necessario per l'attivazione degli stessi) con il risultato di bloccare la progressione della malattia nei topi diabetici.
I risultati sono molto interessanti ma, per loro natura, ancora lontani dall'applicazione clinica. Bisognerà attendere le prove di sicurezza in essere umano e iniziare studi clinici dedicati prima di potere fare una previsione sul se e quando il metodo diventerà una vera opzione terapeutica.
Se i dati venissero confermati il vantaggio sarebbe duplice: ripristinare l'espressione dell'insulina e bloccare l'attacco immunitario contro le cellule beta del pancreas.
Un diverso approccio è quello testato da un team di ricerca americano basato sul trapianto di cellule di pancreas; esperimenti condotti su topi. L'approccio in se non ha nulla di nuovo in quanto già testato ampiamente sugli esseri umani ma con risultati solo temporanei: dato che il sistema immunitario del ricevente è "attivato" verso la distruzione delle cellule beta del pancreas, il trapianto di nuove cellule avrà effetto solo fintanto che esse non verranno distrutte. Per ovviare a questo problema si cerca da anni di proteggere queste cellule incapsulandole all'interno di qualche struttura porosa (per consentire entrata ed uscita delle molecole). Proprio in questo sta la novità dell'articolo del gruppo di ricerca del MIT: cellule umane incapsulate in gel derivato dall'alginato (un polisaccaride estratto dalle alghe) sono state trapiantate in topi diabetici e, senza alcun altro trattamento, si sono dimostrate capaci di tenere sotto controllo la glicemia per circa 6 mesi.
Anche in questo caso, altri test (e miglioramenti sulla durata) sono necessari prima di iniziare la sperimentazione su essere umano.
Se i dati venissero confermati il vantaggio sarebbe duplice: ripristinare l'espressione dell'insulina e bloccare l'attacco immunitario contro le cellule beta del pancreas.
***
Un diverso approccio è quello testato da un team di ricerca americano basato sul trapianto di cellule di pancreas; esperimenti condotti su topi. L'approccio in se non ha nulla di nuovo in quanto già testato ampiamente sugli esseri umani ma con risultati solo temporanei: dato che il sistema immunitario del ricevente è "attivato" verso la distruzione delle cellule beta del pancreas, il trapianto di nuove cellule avrà effetto solo fintanto che esse non verranno distrutte. Per ovviare a questo problema si cerca da anni di proteggere queste cellule incapsulandole all'interno di qualche struttura porosa (per consentire entrata ed uscita delle molecole). Proprio in questo sta la novità dell'articolo del gruppo di ricerca del MIT: cellule umane incapsulate in gel derivato dall'alginato (un polisaccaride estratto dalle alghe) sono state trapiantate in topi diabetici e, senza alcun altro trattamento, si sono dimostrate capaci di tenere sotto controllo la glicemia per circa 6 mesi.
Anche in questo caso, altri test (e miglioramenti sulla durata) sono necessari prima di iniziare la sperimentazione su essere umano.
(articolo precedente sul tema --> "vaccino contro il diabete giovanile")
Fonte
- Insulin B chain 9–23 gene transfer to hepatocytes protects from type 1 diabetes by inducing Ag-specific FoxP3+ Tregs
Mahzad Akbarpour et al, Sci. Transl. Med. 7, 289ra81 (2015)
-Long-term glycemic control using polymer-encapsulated human stem cell-derived beta cells in immune-competent mice.
Vegas AJ et al, Nat Med. 2016 Jan 25
Vegas AJ et al, Nat Med. 2016 Jan 25

Nessun commento:
Posta un commento